题目内容
某同学为了研究化学实验室中某块白色固体的性质,进行了如下实验,其中你认为不正确的实验方案是( )A.观察固体的颜色和外观
B.放入水中试其溶解性
C.用嘴尝其味道
D.加热观察是否有变化
解答:解:A、观察固体的颜色和外观,说法正确,故A正确;
B、放入水中试其溶解性,说法正确,故B正确;
C、用嘴尝其味道,说法错误,因为不得品尝任何药品的味道,防止中毒或受腐蚀,故C错误;
D、加热观察是否有变化,说法正确,故D正确.
故选C.
点评:了解具备基本的化学实验技能是学习化学和进行化学探究活动的基础和保证.只有掌握化学实验的基本技能,才能安全、准确地进行化学实验.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案某化学兴趣小组回收利用废旧干电池。
实验 1 回收填料中的二氧化锰和氯化铵
查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可于水。兴趣小组的同学们设计回收物质的流程如图 12 所示。
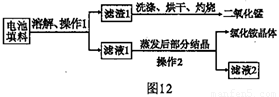
(1)操作1 和操作2 的名称都是____________,该操作中玻璃棒的作用是____________。
(2)灼烧滤渣 l 的目的是________________________ 。
(3)己知滤液 1 中氯化铵和氯化锌的浓度相近。在某温度下蒸发滤液1 时,大量的氯化铵晶体先析出,说明该温度下氯化铵溶解度____氯化锌的溶解度(填“<”、“=”或“>”)。
实验 2 利用外壳回收物锌制取氢气及相关探究
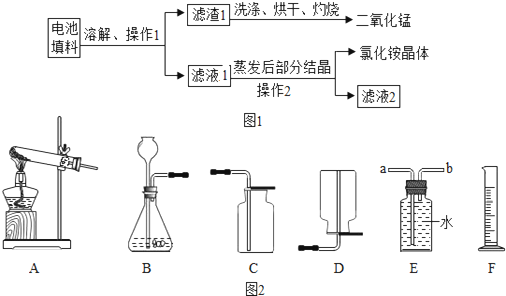
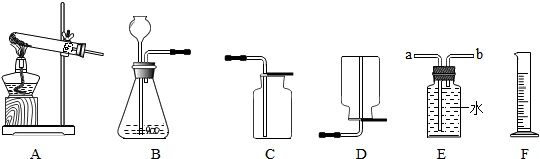
(4)用锌和稀硫酸制取氢气。己知氢气密度比空气小且难溶于水,提供装置如图 13 。
① 应选择:发生装置为____(填编号),排空气法收集装置为____(填编号)。
② 若用排水法收集并测定气体的体积,气体从装置 B 导管口____(填“ a ”或“ b ” ) 进;选用仪器 F 测量排出水的体积,仪器 F 名称是________。

(5)探究影响锌与稀硫酸反应快慢的因素。反应过程中,用前 10 min 内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
|
验实号编 |
试剂 |
前 10 min 内产生的氢气体积(mL) |
|
|
不同纯度的锌 |
不同体积和浓度的稀硫酸 |
||
|
a |
纯锌 |
30 mL 30 % |
564.3 |
|
b |
含杂质的锌 |
30 InL 30 % |
634.7 |
|
c |
纯锌 |
30 mL 20 % |
449.3 |
|
d |
纯锌 |
40 mL 30 % |
602.8 |
① 比较实验 a 和实验 b ,可以得到的结论是________________________。
② 为了研究硫酸浓度对反应快慢的影响,需比较实验_____和实验_____(填编号)。
③ 控制其他条件相同,需控制的条件是______________________(例举一种条件即可)。
某实验小组利用废硫酸液制备K2SO4并研究CaSO4•2H2O加热分解的产物。
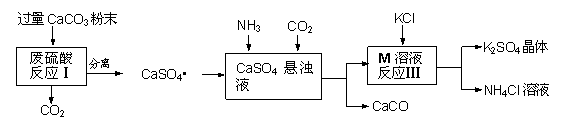 一、K2SO4的制备
一、K2SO4的制备
(1)将CaCO3研成粉末的目的是 ▲ 。
(2)上述流程中可循环使用的物质有CO2和 ▲ (填写化学式)。
(3)反应Ⅲ中相关物质的溶解度如下表。你认为反应Ⅲ在常温下能实现的原因是 ▲ 。
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是 ▲ ;为检验此晶体是否洗涤干净,可取最后 一次洗涤液,先加入 ▲ (选填序号,下同),振荡、静置,再向上层清液中滴加 ▲ ,观察现象即可判断。
一次洗涤液,先加入 ▲ (选填序号,下同),振荡、静置,再向上层清液中滴加 ▲ ,观察现象即可判断。
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
(5)分离所得的CaSO4•2H2O含有CaCO3,可用盐酸除去,该的化学反应方程式 ▲ 。
 (6)为了测定CaSO4•2H2O和CaCO3的质量比x:y,实验小组利用下图所示的装置(夹持仪器省略)进行实验。
(6)为了测定CaSO4•2H2O和CaCO3的质量比x:y,实验小组利用下图所示的装置(夹持仪器省略)进行实验。
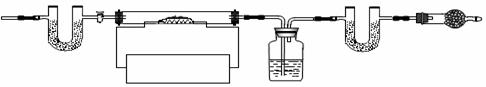
 |
|
①实验前首先要 ▲ ,再装入样品。装置A的作用是 ▲ 。
②已知CaSO4•2H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全。现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g

 某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将 ▲ (填“偏大”、“偏小”或“无影响”)。你认为还可选用上述的 ▲
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将 ▲ (填“偏大”、“偏小”或“无影响”)。你认为还可选用上述的 ▲  (选填序号)两个数据组合也可求出x:y的值。
(选填序号)两个数据组合也可求出x:y的值。
(7)CaSO4•2H2O受热会逐步失去结晶水。取纯
净CaSO4•2H2O固体3.44g,放在(5)的实
验装置B中进行加热,测定固体质量随温
度的变化情况如右图所示。
①G点固体的化学式是 ▲ 。
②将T2~1400℃温度段加热固体所产 生的
生的
气体
|
则H~I段发生反应的化学方程式为 ▲ 。