题目内容
(2013?厦门)某化学兴趣小组回收利用废旧干电池.
实验 1 回收填料中的二氧化锰和氯化铵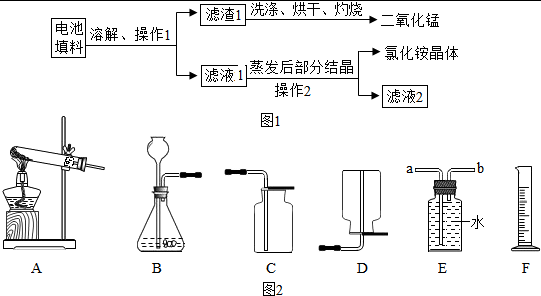
查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水.兴趣小组的同学们设计回收物质的流程如图1所示.
(1)操作 1 和操作 2 的名称都是
(2)灼烧滤渣 l 的目的是
(3)己知滤液 1 中氯化铵和氯化锌的浓度相近.在某温度下蒸发滤液 1 时,大量的氯化铵晶体先析出,说明该温度下氯化铵溶解度
实验 2 利用外壳回收物锌制取氢气及相关探究
(4)用锌和稀硫酸制取氢气.己知氢气密度比空气小且难溶于水,提供装置如图 2.
①应选择:发生装置为
②若用排水法收集并测定气体的体积,气体从装置 B 导管口
(5)探究影响锌与稀硫酸反应快慢的因素.反应过程中,用前 10min 内收集的氢气体积比较反应的快慢.控制其他条件相同,进行下表四组实验,获得数据如下表.
①比较实验 a 和实验 b,可以得到的结论是
②为了研究硫酸浓度对反应快慢的影响,需比较实验
③控制其他条件相同,需控制的条件是
实验 1 回收填料中的二氧化锰和氯化铵

查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水.兴趣小组的同学们设计回收物质的流程如图1所示.
(1)操作 1 和操作 2 的名称都是
过滤
过滤
,该操作中玻璃棒的作用是引流
引流
.(2)灼烧滤渣 l 的目的是
除去炭粉
除去炭粉
.(3)己知滤液 1 中氯化铵和氯化锌的浓度相近.在某温度下蒸发滤液 1 时,大量的氯化铵晶体先析出,说明该温度下氯化铵溶解度
<
<
氯化锌的溶解度(填“<”、“=”或“>”).实验 2 利用外壳回收物锌制取氢气及相关探究
(4)用锌和稀硫酸制取氢气.己知氢气密度比空气小且难溶于水,提供装置如图 2.
①应选择:发生装置为
B
B
(填编号),排空气法收集装置为D
D
(填编号).②若用排水法收集并测定气体的体积,气体从装置 B 导管口
b
b
(填“a”或“b”) 进;选用仪器 F 测量排出水的体积,仪器 F 名称是量筒
量筒
.(5)探究影响锌与稀硫酸反应快慢的因素.反应过程中,用前 10min 内收集的氢气体积比较反应的快慢.控制其他条件相同,进行下表四组实验,获得数据如下表.
| 验实号编 | 试剂 | 前 10min 内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30mL 30% | 564.3 |
| b | 含杂质的锌 | 30mL 30% | 634.7 |
| c | 纯锌 | 30mL 20% | 449.3 |
| d | 纯锌 | 40mL 30% | 602.8 |
与同体积同浓度的稀硫酸反应,含杂质的锌比纯锌反应速率要快
与同体积同浓度的稀硫酸反应,含杂质的锌比纯锌反应速率要快
.②为了研究硫酸浓度对反应快慢的影响,需比较实验
a
a
和实验c
c
(填编号).③控制其他条件相同,需控制的条件是
温度(或锌粒形状大小)
温度(或锌粒形状大小)
(例举一种条件即可).分析:(1)根据操作1和操作2分离混合物的状态及过滤可用于难溶性固体和可溶性固体的分离进行分析;
(2)根据滤渣的成分及实验的目的分析;
(3)根据等浓度的溶液,等温度下蒸发,溶解度小的先析出分析;
(4)①根据反应物的状态和反应条件选择发生装置;根据气体的密度和溶解性选择收集装置;
②根据排水法收集气体的原理及装置F的实验目的分析;
(5)①通过表格比较实验的相同点和不同点得出结论;
②利用控制变量法分析自变量是硫酸的浓度,因变量是反应的快慢进行分析选择对比组;
③从外因寻找需要控制的条件:温度,颗粒大小等.
(2)根据滤渣的成分及实验的目的分析;
(3)根据等浓度的溶液,等温度下蒸发,溶解度小的先析出分析;
(4)①根据反应物的状态和反应条件选择发生装置;根据气体的密度和溶解性选择收集装置;
②根据排水法收集气体的原理及装置F的实验目的分析;
(5)①通过表格比较实验的相同点和不同点得出结论;
②利用控制变量法分析自变量是硫酸的浓度,因变量是反应的快慢进行分析选择对比组;
③从外因寻找需要控制的条件:温度,颗粒大小等.
解答:解:(1)根据流程图操作1和操作2都是不溶性固体和液体的分离,因此是过滤操作,过滤时玻璃棒起到引流的作用;
(2)因为废旧干电池填料的主要难溶性物质为二氧化锰、炭粉,因此溶解过滤后的滤渣含有二氧化锰和碳粉,而回收二氧化锰,因此通过灼烧可以把碳粉变成二氧化碳,因此灼烧滤渣 l 的目的是除去碳粉;
(3)因为氯化铵和氯化锌的浓度相近,在某温度下蒸发滤液 1 时,大量的氯化铵晶体先析出,说明该温度下氯化铵溶解度<氯化锌的溶解度;
(4)①用锌和稀硫酸制取氢气,因此发生装置属于固液常温型的B装置;因为氢气密度比空气小且难溶于水,因此可以采用排水法或向下排空气法收集;
②若通过E装置采用排水发生收集氢气,氢气不易溶于水,因此会聚集在水的上方,因此进气管是短管;
要量取收集的氢气的体积,利用仪器F-量筒通过量取排出水的体积就是氢气的体积测定;
(5)①实验 a 和实验 b,相同点是同体积同浓度的稀硫酸,不同点是含杂质的锌和纯锌,结果含杂质的锌比纯锌反应速率要快;
②要研究硫酸浓度对反应快慢的影响,需要不同浓度的硫酸,而要控制锌的纯度相同,比较产生氢气的快慢,因此对比组是a和c;
③控制变量法需要考虑的是自变量和因变量,而其它外界条件均保存相同,因此控制其他条件相同,需控制的条件如;温度(或锌粒形状大小).
故答案为:(1)过滤;引流;(2)除去碳粉;(3)<;(4)①B,D; ②b,量筒;
(5)①与同体积同浓度的稀硫酸反应,含杂质的锌比纯锌反应速率要快;②a和c; ③温度(或锌粒形状大小).
(2)因为废旧干电池填料的主要难溶性物质为二氧化锰、炭粉,因此溶解过滤后的滤渣含有二氧化锰和碳粉,而回收二氧化锰,因此通过灼烧可以把碳粉变成二氧化碳,因此灼烧滤渣 l 的目的是除去碳粉;
(3)因为氯化铵和氯化锌的浓度相近,在某温度下蒸发滤液 1 时,大量的氯化铵晶体先析出,说明该温度下氯化铵溶解度<氯化锌的溶解度;
(4)①用锌和稀硫酸制取氢气,因此发生装置属于固液常温型的B装置;因为氢气密度比空气小且难溶于水,因此可以采用排水法或向下排空气法收集;
②若通过E装置采用排水发生收集氢气,氢气不易溶于水,因此会聚集在水的上方,因此进气管是短管;
要量取收集的氢气的体积,利用仪器F-量筒通过量取排出水的体积就是氢气的体积测定;
(5)①实验 a 和实验 b,相同点是同体积同浓度的稀硫酸,不同点是含杂质的锌和纯锌,结果含杂质的锌比纯锌反应速率要快;
②要研究硫酸浓度对反应快慢的影响,需要不同浓度的硫酸,而要控制锌的纯度相同,比较产生氢气的快慢,因此对比组是a和c;
③控制变量法需要考虑的是自变量和因变量,而其它外界条件均保存相同,因此控制其他条件相同,需控制的条件如;温度(或锌粒形状大小).
故答案为:(1)过滤;引流;(2)除去碳粉;(3)<;(4)①B,D; ②b,量筒;
(5)①与同体积同浓度的稀硫酸反应,含杂质的锌比纯锌反应速率要快;②a和c; ③温度(或锌粒形状大小).
点评:本题考查了废电池的物质的回收及有关氢气的制取的探究,知识点较多,属于化学实验基本实验技能的考查,要求在平时的学习中要注意掌握常见的化学操作及其原理,熟练运用.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目