题目内容
【题目】已知A~E是初中化学的常见物质,A和D是两种常见的碱,B的水溶液是一种常见的酸,且只含有两种元素,C是一种钠盐,其溶液显碱性,它们之间的关系如图所示。 “﹣”表示两种物质间发生反应,“→”表示两种物质间的转化关系。请回答:
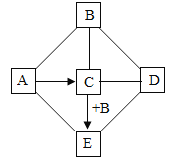
(1)C的化学式是____;
(2)C与D的反应属于____反应(填基本反应类型);
(3)A→C反应的化学方程式是________________。
【答案】Na2CO3 复分解 2NaOH+CO2═Na2CO3+H2O
【解析】
A-E是初中化学的常见物质,A和D是两种常见的碱,B是一种常见的酸,且只含有两种元素,所以B可能是盐酸;C是一种钠盐,其溶液显碱性,且能与盐酸反应,所以C可能是碳酸钠;E是碳酸钠和盐酸反应的产物,且能够与两种碱反应,所以E是二氧化碳;A会转化成碳酸钠,所以A是氢氧化钠,D会与碳酸钠反应,所以D可以是氢氧化钙,经过验证,推出的各种物质均满足题中的转化关系,推导正确。
(1)C是碳酸钠,碳酸钠的化学式是Na2CO3;故填:Na2CO3;
(2)C与D的反应是碳酸钠和氢氧化钙的反应生成碳酸钙沉淀和氢氧化钠,该反应是两种化合物交换成分生成另外两种化合物,属于复分解反应。故填:复分解;
(3)A→C反应是氢氧化钠和二氧化碳反应生成碳酸钠和水,反应的化学方程式是2NaOH+CO2═Na2CO3+H2O。故填:2NaOH+CO2═Na2CO3+H2O。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】看图并请从A或B两题中任选1个作答,若两题均作答,只一组计分。
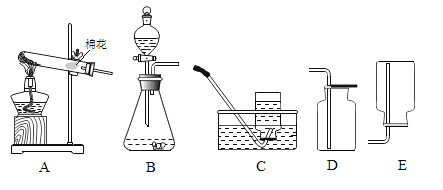
A | B |
(1)用装置A制备一瓶氧气,其制备原理为_____(写出化学反应的方程式)。 (2)氧气可用C装置收集,还可以用__收集(填写装置编号)。 | (1)装置B可用于实验室制取二氧化碳。写出制取CO2反应的化学方程式为__。 (2)收集二氧化碳可选择___(填写装置编号)。 |
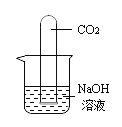
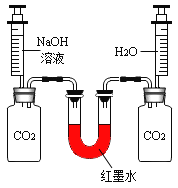
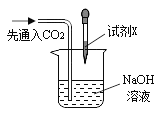
【题目】化学实验室里,同学们准备研究氢氧化钠能与二氧化碳反应的化学性质。
①在配制NaOH溶液时,看到盛有NaOH固体的试剂瓶上标注着“NaOH含量不少于96.0%”,便对该瓶试剂成分产生了质疑:
[提出问题]氢氧化钠中含有什么杂质?
[查阅资料]工业上制取NaOH的反应原理: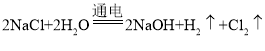 然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
[提出猜想]
甲同学认为杂质只有氯化钠;
乙同学认为杂质还可能含有碳酸钠,原因为_______ (用化学方程式表示)。
[设计实验]取样溶于水,并分成两份。
步骤1:向一份溶液中滴加酚酞试液,溶液变_________色。
步骤2:向另一份溶液中滴加过量稀硝酸,有气泡产生。
步骤3:向步骤 2所得溶液中继续滴加_________溶液,发现有白色沉淀产生。
[实验结论]乙同学的猜想正确。
请
Ⅰ.上述实验中步骤_____(填序号)是没有必要进行的。
II.步骤2所得溶液中的溶质有________。
②同学们在配制好的氢氧化钠溶液中通入CO2气体,没有明显现象,于是设计了如下实验证明反应的发生:(不考虑氢氧化钠中的极少量杂质)
实验1 | 实验2 | 实验3 |
现象:烧杯中溶液几乎充满整个试管。 |
现象: 充分反应后,红墨水最终呈现左高右低现象。 |
现象: 滴加试剂X后,溶液中出现大量白色沉淀。 |
I .实验3中加入的试剂X是_______ (任写一种符合要求的试剂)。
II.实验1、2在设计思想上是一致的,都是通过验证反应物的消耗才能观察到明显现象,但有同学对实验1提出了质疑,他认为这个实验不足以证明CO2与NaOH发生了化学反应,其理由是_______。
Ⅲ.查阅资料:室温下,氢氧化钠易溶于酒精,而碳酸钠难溶于酒精。据此,同学们设计了实验4,请你补充完整。
实验4步骤 | 实验现象 | 实验结论 | 实验分析 |
将CO2气体不断地通入氢氧化钠酒精溶液中,观察现象。 | _______ | 氢氧化钠与二氧化碳确实发生了化学反应。 | 实验4与实验____(填实验序号)的设计思想是一致的,都是根据生成物的性质才能观察到明显现象。 |