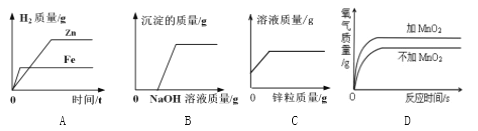
题目内容
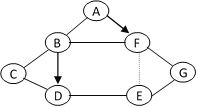
【题目】下图中A~I是初中化学常见的物质,且分别是由一种至三种元素组成。I为单质,被誉为最清洁的燃料,其它均为化合物。G、D属于盐,A、E、F属于氧化物,且E中两种元素质量比为3∶8,B、C、D形成的水溶液均能使酚酞变红。图中“—”表示能相互反应,图中“→”表示转化关系,(部分反应物、生成物及反应条件已略去)。
(1)写出I的化学式 _________ ;D的化学式 ____________。
(2)写出B→C反应的化学方程式_______________;写出E→G反应的化学方程式________。
(3) A→B的反应________(填“放出”或“吸收”)热量。
【答案】 H2 Na2CO3(K2CO3) Ca(OH)2+ Na2CO3 =CaCO3↓+2NaOH或Ca(OH)2+ K2CO3 ==CaCO3↓+2KOH CO2+ Ca(OH)2 == CaCO3↓+H2O 放出
【解析】I为单质,被誉为最清洁的燃料,所以A为氢气;A、E、F属于氧化物,且E中两种元素质量比为3∶8,所以E为二氧化碳;A~I是初中化学常见的物质,且分别是由一种至三种元素组成。G、D属于盐, B、C、D形成的水溶液均能使酚酞变红。所以D为碳酸钠或碳酸钾;由B、C、D间的转化关系可知B为氢氧化钙,C为氢氧化钠,氢氧化钙和碳酸钠反应生成氢氧化钠,氢氧化钠和二氧化碳反应生成碳酸钠和水。氢氧化钠和氢氧化钙均能通过与非金属氧化物或酸反应转化成水,水能分解生成氢气,所以F是水。H为盐酸或硫酸,A是氧化钙。将推断结果带入关系图验证,推断成立。(1)氢气的化学式H2;D为碳酸钠或碳酸钾,化学式 Na2CO3(K2CO3);(2)氢氧化钙转化成氢氧化钠的反应化学方程式:Ca(OH)2+ Na2CO3 =CaCO3↓+2NaOH或Ca(OH)2+ K2CO3 ==CaCO3↓+2KOH ;二氧化碳转化成碳酸钙的化学方程式CO2+ Ca(OH)2 == CaCO3↓+H2O; (3) 氧化钙和水反应生成氢氧化钙,反应放出大量热量。

【题目】某化学小组为了探究一瓶久置在空气中的氢氧化钠样品(不含有水分)的变质程度,进行了如下实验:取该氢氧化钠样品13.3 g于烧杯中,加水完全溶解,然后向烧杯中逐渐加入一定溶质质量分数的氯化钡溶液,反应过程中对加入氯化钡溶液的质量与烧杯中产生沉淀的质量进行了记录,部分数据见下表:
加入氯化钡溶液的质量/g | 20 | 40 | 80 | 100 |
生成沉淀的质量/g | 1.97 | 3.94 | 5.91 | 5.91 |
试分析计算:
(1)13.3g氢氧化钠样品中碳酸钠的质量_______;
(2)该氯化钡溶液的质量分数___________。