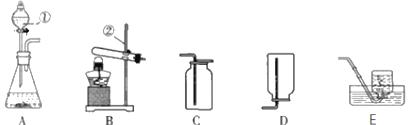题目内容
【题目】下列图像能正确反映其对应关系的是( )
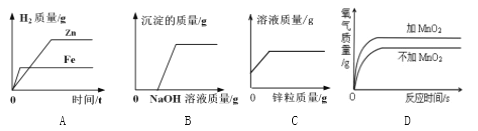
A. 向等质量的锌片、铁片分别加入足量的等质量分数的稀硫酸
B. 向CuSO4溶液中滴加NaOH溶液
C. 向一定量的稀硫酸中加入锌粒
D. 两份等体积的5%过氧化氢溶液,向其中一份加入少量二氧化锰
【答案】C
【解析】A、向等质量的锌片、铁片分别加入足量的等质量分数的稀硫酸,锌和稀硫酸反应较快,铁和稀硫酸反应生成的氢气质量较大,错误;B、向CuSO4溶液中滴加NaOH溶液,氢氧化钠溶液会与硫酸铜溶液反应,直接生成沉淀,错误;C、锌和稀硫酸发生置换反应,一个锌原子将一个氢气分子置换出来,而一个锌原子比一分子氢气重,所以随着反应的进行溶液质量增大,当硫酸反应完后,溶液质量不再增加,原溶液有一定的质量,所以曲线不从零开始,正确;D、二氧化锰只起改变反应速率的作用。两份等体积的5%过氧化氢溶液完全分解,产生氧气的质量相等,错误。故选C。

【题目】兴趣小组在做完盐的性质实验后,发现一瓶碳酸钠固体可能混入了氯化钠,硫酸钠中的一种或两种。为此,他们对这瓶固体的成分进行了探究。
(实验验证)
实验步骤 | 现象 | 结论、分析及化学方程式 |
(1)取少量该样品于于试管中,加入足量的水,溶解得到溶液。滴入过量的稀硝酸,再滴入过量的硝酸钡溶液。 | _____________ | 说明该固体中没有有硫酸钠。 先加入过量的硝酸的目的 是__________________。 |
(2)再继续滴入几滴硝酸银溶液。 | 有白色沉淀生成。 | 说明该固体中__________。实验结束所得溶液中一定含有的阳离子是_____。 |
(定量探究)(1)甲同学还想测定该固体中碳酸钠的质量分数,利用如图所示的实验装置(气体气密性良好)进行实验,每一步反应均完全进行。
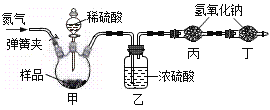
①为达实验目的,首先称取一定质量的该固体样 品放入装置甲中,然后进行有关实验操作, 正确的顺序是__________________(填序号,可重复)。
a.称量装置丙。 b.打开弹簧夹,通入足量的氮气,关闭弹簧夹。
c.打开分液漏斗的活塞,注入足量的稀硫酸,关闭活塞。
②装置乙的作用是______________________。
(2)乙同学取该碳酸钠样品12g,加水配成溶液,加入足量的氯化钙溶液,过滤,洗涤,烘干。称得滤渣质量为10g。请通过计算确定该样品中Na2CO3的质量分数_______。(结果保留1位小数。)