题目内容
【题目】往100g未知质量分数的过氧化氢溶液,加入二氧化锰,反应一段时间后称量反应装置的质量减少了1.6g,同时测得此时过氧化氢溶液的质量分数为1%,试计算:
(1)过氧化氢中氢氧元素的质量比为_________,生成氧气的质量为____________g.
(2)求原溶液中溶质的质量分数_______?(保留小数点后面两位有效数字)
【答案】1:8; 1.6 4.38%
【解析】
(1)根据物质的化学式和质量守恒定进行相关的计算;
(2)根据过氧化氢完全分解的化学反应方程式,将氧气的质量代入化学反应方程式计算即可参加反应的过氧化氢的质量,进一步计算原溶液中溶质的质量分数。
解:(1)H2O2中,氢、氧元素的质量比为:(1×2):(16×2)=1:8;根据质量守恒定律,反应后减少的质量为生成氧气的质量,所以生成氧气的质量为1.6g;
(2)设参加反应的过氧化氢的质量为x,则:
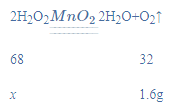
![]()
x=3.4g;
设原溶液中溶质的质量分数为y,则:![]() ×100%=1%,
×100%=1%,
y≈4.38%;
答:原溶液中溶质的质量分数为4.38%。

练习册系列答案
相关题目