题目内容
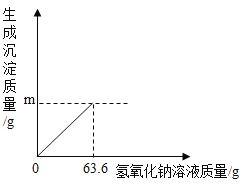
【题目】镁在国产大飞机“C -919”的制造中大显身手,小亮在实验室模拟“海水制镁”的原理来富集镁,他将25 g氯化钠和氯化镁的固体混合物全部溶解于盛有70 g水的烧杯中,然后向其中加入63. 6 g氢氧化钠溶液至恰好完全反应(图象如图),过滤,称量滤液质量为147g,求:
(1)图象中m=_______g。
(2)滤液中溶质的质量分数是多少? (写出计算过程,精确到0.1)____________
【答案】11.6 20.0%
【解析】
(1)根据质量守恒定律可知,反应前后的总质量不变,所以生成的沉淀的质量为25g+70g+63.6g-147g=11.6g,因此图像中m=11.6g,故填:11.6g;
(2)向氯化钠和氯化镁和混合溶液中加入氢氧化钠溶液至恰好完全反应,氯化镁与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,因此反应后的溶液中的溶质是氯化钠,包含原有的和生成的两部分;
设氯化镁的质量为x,生成的氯化钠为y
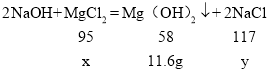
![]()
![]()
解得x=19g,y=23.4g;
样品中原有的氯化钠的质量为25g-19g=6g
滤液中氯化钠的质量分数为:![]()
答:滤液中溶质的质量分数是20.0%。

练习册系列答案
相关题目