题目内容
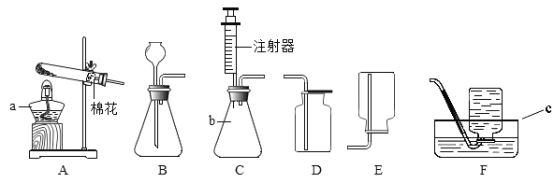
【题目】初中化学课上,同学们利用下列实验探究碱的部分化学性质。(提示信息:CaCl2溶液和NaCl溶液均为中性)
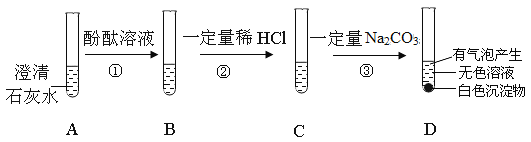
(1)步骤①中观察到的现象是_____。
(2)D试管中产生的气泡是指_____(填化学式),产生白色沉淀的化学反应方程式为_____。
(3)下列关于上述实验分析正确的是_____。
A D试管中的溶质可能有Na2CO3、NaCl、酚酞
B C试管中的溶质是CaCl2和HCl
C D试管中溶液的pH=7
D 为了确定D试管中溶质成分,可用Na2CO3溶液
【答案】无色溶液变红 CO2 CaCl2+Na2CO3=CaCO3↓+2NaCl BCD
【解析】
(1)澄清石灰水呈碱性,能使无色酚酞溶液变红色,步骤①中观察到的现象是无色溶液变红;
(2)B试管中氢氧化钙溶液中加入一定量稀盐酸,所得C管中溶液是氯化钙溶液(恰好完全反应)或氯化钙与盐酸的混合溶液(盐酸过量)或氯化钙和氢氧化钙混合溶液(氢氧化钙过量),再加入一定量碳酸钠溶液,产生了气泡和白色沉淀,碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,氯化钙与碳酸钠反应生成碳酸钙沉淀和氯化钠,所以C管中溶液是氯化钙与盐酸的混合溶液,D试管中产生的气泡是指CO2,产生白色沉淀的化学反应方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl;
(3)A. D试管中溶液呈无色,碳酸溶液呈碱性,其中的溶质不可能有Na2CO3,故A错误;
B.根据第(2)小题的分析可知,C试管中的溶质是CaCl2和HCl,故B正确;
C.试管中溶液的pH=7,原因是C试管中的溶质是CaCl2和HCl加入碳酸钠溶液时,碳酸钠先与盐酸反应,等盐酸完全反应后再与氯化钙反应,实验过程中产生白色沉淀,说明盐酸已完全消耗,溶液呈无色,说明溶液呈中性,故C正确;
D.根据C选项的分析,溶液中已无盐酸,还可能存在氯化钙,氯化钙能与碳酸钠反应生白色沉淀,为了确定D试管中溶质成分,可用Na2CO3溶液,故D正确。故选BCD。

【题目】溶洞都分布在石灰岩组成的山洞中,石灰岩的主要成分是碳酸钙,当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O=Ca(HCO3)2。某化学兴趣小组同学们思考:若向碳酸钠溶液中通入一定量二氧化碳,是否能生成碳酸氢钠(NaHCO3)?于是他们开始实验探究。(不考虑二氧化碳和碳酸作为溶质的情况)
[提出问题]所得溶液中所含溶质成分是什么?
[查阅资料]碳酸氢钠溶液呈碱性。
[提出猜想]猜想一,溶质为Na2CO3;
猜想二:溶质为NaHCO3;
猜想三:溶质为_______。
[设计实验]
实验步骤 | 实验现象 | 实验结论 |
①取所得溶液少许于试管中,向其中滴加过量的CaCl2溶液 | 有白色沉淀生成 | 猜想二______________(填“成立”或“不成立”) |
②取实验步骤①中上层清液,滴加适量稀盐酸 | 有气泡冒出 | 猜想一不成立 |
[得出结论]猜想三成立,证明二氧化碳通入碳酸钠溶液生成了碳酸氢钠。写出实验步骤②中发生反应的化学方程式:_____________________________________。
[讨论交流]碳酸氢钠的俗名叫___________。小明同学认为,向碳酸钠溶液中通入一定量二氧化碳后,再向所得溶液中滴加几滴酚酞溶液。溶液变红就能证明一定有碳酸氢钠生成;小红同学对小明同学的结论产生质疑,其理由是___________________________。
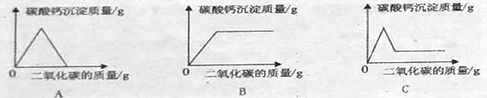
[拓展应用]同学们回忆超实验室用澄清石灰水检验二氧化碳的情景,结合上述知识,如果向一定量的澄清石灰水中不断通入二氧化碳气体,下列哪一个图像能正确反映生成的碳酸钙沉淀与二氧化碳的质量之间的变化关系_________(填字母序号)。