题目内容
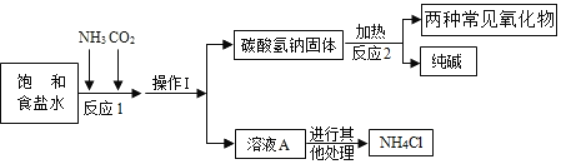
【题目】碳酸钠广泛用于造纸、纺织、洗涤剂等工业。是一种重要的化工原料,工业制碱法的原理是:![]() ,然后加热分解
,然后加热分解![]() 固体得到
固体得到![]() ,兴趣小组采用下列装置模拟工业制碱法制备碳或氢钠,进而制得碳酸钠。
,兴趣小组采用下列装置模拟工业制碱法制备碳或氢钠,进而制得碳酸钠。
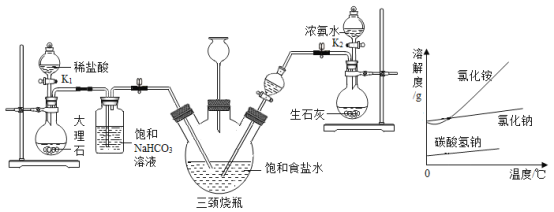
(查阅资料)氨气易溶于水,通常状况下1体积水约溶解700体积的氮气;二氧化碳能溶于水,通常状况下1体积水约溶解1体积的二氧化碳。
(实验过程)
(1)关闭![]() ,打开
,打开![]() 通入
通入![]() 并调节气流速率,然后打开
并调节气流速率,然后打开![]() 通入
通入![]() 。
。
(2)当三颈烧瓶内出现较多固体时,先后停止通入两种气体。
(3)将三颈烧瓶内反应后的混合物过滤、洗涤,并将所得固体加热充分加热。
(问题讨论)
(1)停止通气后三颈烧瓶内的溶液是否是![]() 的饱和溶液?________,洗气瓶中饱和
的饱和溶液?________,洗气瓶中饱和![]() 溶液的作用是__________________(用化学方程式表示)。
溶液的作用是__________________(用化学方程式表示)。
(2)实验中长颈漏斗的作用是____________________。有同学认为应在长颈漏斗内放置蘸有酸液的棉花,理由是_________________。
(3)依据“查阅资料”所得信息,实验结束时应先停止通![]() 还是
还是![]() ?________,已知氯化铵、氯化钠和碳酸氢钠的溶解度如右图所示,从反应后的滤液里得到氯化铵固体可采用的方法是________________。
?________,已知氯化铵、氯化钠和碳酸氢钠的溶解度如右图所示,从反应后的滤液里得到氯化铵固体可采用的方法是________________。
(4)实验过程中先通入![]() ,能充分吸收
,能充分吸收![]() 的原因是_______________。实验中用生石灰能更好地产生氨气,理由是__________________、____________________。
的原因是_______________。实验中用生石灰能更好地产生氨气,理由是__________________、____________________。
(5)加热分解![]() 固体得到
固体得到![]() ,判断得到的
,判断得到的![]() 固体中是否有
固体中是否有![]() 剩余的方法是_________________________。
剩余的方法是_________________________。
【答案】是 ![]() 平衡气压(或调解气压、防装置内气压过大) 吸收
平衡气压(或调解气压、防装置内气压过大) 吸收![]() (或酸能和
(或酸能和![]() 反应、或
反应、或![]() 是碱性气体、或处理尾气) 先停止通
是碱性气体、或处理尾气) 先停止通![]() 降温结晶法 氨气溶于水溶液显碱性,二氧化碳的水溶液显酸性 氧化钙和水反应生成氢氧化钙 反应放热(或放热) 取固体样品,加热,观察试管口是否有水珠生成
降温结晶法 氨气溶于水溶液显碱性,二氧化碳的水溶液显酸性 氧化钙和水反应生成氢氧化钙 反应放热(或放热) 取固体样品,加热,观察试管口是否有水珠生成
【解析】
(1)析出晶体后的溶液是饱和溶液,当三颈烧瓶内出现较多固体时,先后停止通入两种气体,所以停止通气后三颈烧瓶内的溶液是NaHCO3的饱和溶液,碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑;
(2)长颈漏斗与外界空气相同,三颈烧瓶上连接的长颈漏斗的主要作用是平衡气压;有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,氨气极易溶于水,所以能防止防止氨气逸出污染环境;
(3)关闭K2停止通NH3后,还要继续通一段时间CO2,目的是形成酸性环境,利于使氨气充分反应,氯化铵的溶解度受温度变化影响较大,所以从反应后的滤液里得到氯化铵固体可采用的方法是降温结晶;
(4)实验过程中先通入NH3,能充分吸收CO2的原因是:氨气溶于水,溶液显碱性,二氧化碳的水溶液显酸性,氧化钙和水反应生成氢氧化钙,放出热量,所以实验中用生石灰能更好地产生氨气;
(5)碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,所以判断得到的Na2CO3固体中是否有NaHCO3剩余的方法是:取固体样品,加热,观察试管口是否有水珠生成。
故答案为:(1)是,NaHCO3+HCl═NaCl+H2O+CO2↑;
(2)平衡气压;吸收![]() ;
;
(3)先停止通![]() ;降温结晶;
;降温结晶;
(4)氨气溶于水溶液显碱性,二氧化碳的水溶液显酸性;氧化钙和水反应生成氢氧化钙,放出热量;
(5)取固体样品,加热,观察试管口是否有水珠生成。