题目内容
【题目】某化工厂产生的废液中含有硫酸亚铁和硫酸铜(不考虑其它物质),为回收铜和硫酸亚铁,研究人员设计出“用铁处理”的方案,取100g上述废液,向其中加入2.8g铁粉,恰好完全反应,测得反应后溶液中溶质的质量分数为15%,求:
⑴回收得到铜的质量为多少_______?(写出计算过程)
⑵回收得到硫酸亚铁的质量是_____g(计算结果保留两位小数)。
【答案】 3.2g 14.94g
【解析】废液中含有硫酸亚铁和硫酸铜,取100 g废液,向其中加入2.8 g铁粉,恰好完全反应,测得反应后溶液中溶质的质量分数为15%。(1)解∶设回收得到铜的质量为x,
Fe+CuSO4 =FeSO4+Cu
56 64
2.8g x
![]() =
=![]() ,x=3.2 g
,x=3.2 g
﹙2)回收得到硫酸亚铁的质量是∶﹙100 g-3.2 g﹚×15%=14.94 g
答∶(1)回收得到铜的质量为3.2 g。(2)回收得到硫酸亚铁的质量是14.94 g。
点睛∶正确书写化学方程式和灵活应用质量守恒定律是做好本题的关键。

 阅读快车系列答案
阅读快车系列答案【题目】已知某品牌膨松剂的成分是碳酸氢钠、碳酸氢铵中的一种或两种,某化学兴趣小组为确定该品牌膨松剂的成分,进行如下探究:
查阅资料:
①氨气水溶液呈碱性
②浓硫酸和碱石灰都可做气体吸收剂;浓硫酸能吸收氨气,不能吸收二氧化碳;碱石灰是氧化钙与氢氧化钠固体的混合物,不与氨气反应。
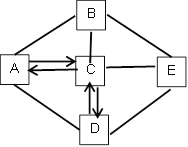
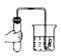
(设计实验)兴趣小组利用如下装置进行探究(装置气密性良好,各装置中气体吸收剂足量);
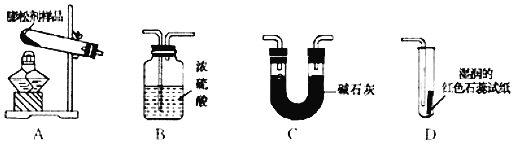
依次连接A、C、D装置,点燃A处的酒精灯,将试管中的该膨松剂样品充分加热至完全反应后,通过观察到_____、_____现象可以证明该膨松剂中含有NaHCO3和 NH4HCO3两种物质。其中装置C的作用是_____。
(拓展探究)为进一步确定该品牌膨松剂中 NaHCO3和NH4HCO3的质量比,同学们取两份等质量的该品牌膨松剂样品,利用图提供的实验装置,设计并进行了如下两组实验:
序号 | 实验操作 | 测得数据 |
实验1 | 将其中的一份膨松剂样品加入A装置试管中,将A装置依次连接B、C装置,充分加热至膨松剂完全反应 | 装置C增重1.98g |
实验2 | 将另一份膨松剂样品加人A装置试管中,将A装置依次连接C、B装置,充分加热至膨松剂完全反应 | 装置B增重0.34g |
基于以上实验数据分析,该品牌膨松剂中 NaHCO3和 NH4HCO3的质量比是_____。
(实验反思)小明认为以上拓展探究实验存在一定误差,导致误差的原因是_____(答一条即可)。