题目内容
【题目】下列说法正确的是()
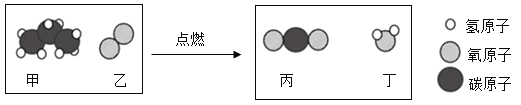
A.甲中碳、氢元素质量比为 3:8B.44g 甲完全燃烧至少需 160g 乙
C.乙和丙的元素组成相同D.生成的丙与丁的分子个数比为 1:1
【答案】B
【解析】
由题目可知,甲为C3H8,乙为O2,丙为CO2,丁为H2O,根据质量守恒定律,配平该反应的化学反应方程式为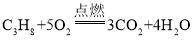 。
。
A、根据题目信息可知,甲的化学式为C3H8,其中碳、氢元素质量比=碳原子个数×碳原子相对原子质量:氢原子个数×氢原子相对原子质量=(3×12):(8×1)=9:2,选项A错误;
B、设44g甲完全燃烧需要乙的质量为m,
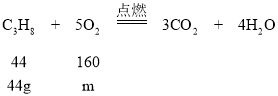
![]() m=160g,由此可以得出44g甲完全燃烧需要160g乙,选项B正确;
m=160g,由此可以得出44g甲完全燃烧需要160g乙,选项B正确;
C、乙为氧气只含有氧元素,丙为二氧化碳,含有碳和氧两种元素,选项C错误;
D、根据反应化学方程式可以看出生成丙和丁的分子个数比为3:4,选项D错误。故选B。

练习册系列答案
相关题目
【题目】一定条件下,测得反应前后各物质的质量变化如下表所示,其中甲和丁的相对分子质量之比为8:9。下列说法中,正确的是
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 2.0 | 20.0 | 3.0 | 20 |
反应后质量/g | 10.0 | x | 3.0 | 29.0 |
A.表中x=17
B.该反应中乙可能是单质
C.该反应中丙一定起催化作用
D.该反应的化学方程式中甲和丁的化学计量数之比为1:1