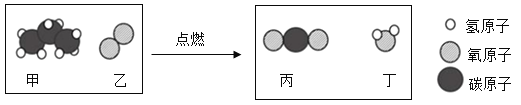
题目内容
【题目】一定条件下,测得反应前后各物质的质量变化如下表所示,其中甲和丁的相对分子质量之比为8:9。下列说法中,正确的是
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 2.0 | 20.0 | 3.0 | 20 |
反应后质量/g | 10.0 | x | 3.0 | 29.0 |
A.表中x=17
B.该反应中乙可能是单质
C.该反应中丙一定起催化作用
D.该反应的化学方程式中甲和丁的化学计量数之比为1:1
【答案】D
【解析】
甲在反应前后质量增加是生成物,生成的质量=10g-2g=8g;丙在反应前后质量不变,可能是该反应的催化剂,也可能没有参加反应,丁在反应前后质量增加是生成物,生成的质量=29g-20g=9g,根据质量守恒定律可知,x=2.0+20.0+3.0+20-10.0-3.0-29.0=3,乙在反应前后质量减少是反应物,参加反应的质量=20g-3g=17g。
A、表中x=3,故A错误;
B、该反应中乙反应物,分解产生甲和丁,乙不可能是单质,故B错误;
C、丙在反应前后质量不变,可能是该反应的催化剂,也可能没有参加反应,故C错误;
D、该反应的化学方程式中甲和丁的化学计量数之比=![]() ,故D正确。故选D。
,故D正确。故选D。

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
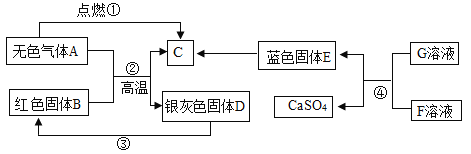
小题狂做系列答案【题目】小刚在家中准备丢弃的红枣袋中发现一袋双吸剂,其标签如图所示。拿到学校后同学们对这包久置的固体样品也很好奇,于是在老师的指导下进行了如下探究:

(提出问题)久置固体的成分是什么?
(作出猜想)久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。
(查阅资料)铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
(实验探究)小刚设计了方案一:
实验操作 | 实验现象 | 实验结论 |
取少量固体放于试管中,滴加足量的______。 | 固体逐渐消失,有无色气泡产生,得到浅绿色溶液。 | 固体中一定含有____,一定不含Fe2O3。 |
同学们认为小刚的方案一并不能得出一定不含Fe2O3的结论,理由是:______。大家讨论后设计如下实验二方案继续验证。
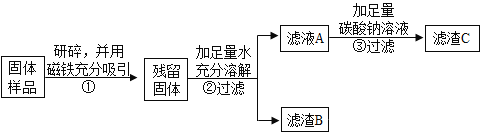
步骤②中固体溶解时放出热量,由此可以判断固体中一定含有________________。 写出该过程中反应的化学方程式______________。
同学们对滤渣B再进行探究:
实验操作 | 实验现象 | 实验结论 |
取滤渣B于试管中,加入适量稀盐酸,生成的气体通入澄清石灰水 | 固体减少,__________,石灰水变浑浊。 | 固体中一定含有CaCO3和Fe2O3。 |
(实验结论) 该久置固体中一定含有Fe、Fe2O3、CaO、CaCO3。
(反思) 食品包装袋内放双吸剂的目的是_________________________________。
【题目】小组同学发现如图所示的两个试管中没有明显现象。为判断两支试管中是否发生了反应,小组同学进行了以下探究。

探究一.探究稀盐酸与氢氧化钠溶液是否发生了化学反应
[实验1]取少量氢氧化钠溶液于试管中,向其中滴加少量______溶液,然后再滴加足量的稀盐酸,观察到溶液颜色发生变化的情况是:先变红,然后_____。
[结论]稀盐酸和氢氧化钠溶液发生了反应。
探究二.探究稀盐酸和硫酸镁溶液是否发生了化学反应
小明决定通过探究试管②溶液中所含有的离子种类来判断反应是否发生。(将试管②的溶液分成两份)
[实验2]
实验 | 现象 | 结论 |
(1)测试管②中溶液的pH | pH<7 | 试管②中溶液含有氢离子 |
(2)向一份试管②的溶液中,加入足量的氢氧化钠溶液 | _________ | 试管②中溶液含有: _______ |
(3)向一份试管②的溶液中加入足量氯化钡溶液 | 产生白色沉淀 | 试管②中溶液含有: _____ |
(4)向(3)所得溶液中加入硝酸银溶液 | 产生白色沉淀 | 试管②中溶液含有氯离子 |
[结论]稀盐酸与硫酸镁溶液没有发生化学反应。
[交流与评价]小亮认为小明的实验不够严谨,其理由是______。为此小亮提出应将小明实验中某一步加入的试剂调整为另一种盐溶液,按照小亮的修改方案,最终得出“稀盐酸与硫酸镁溶液没有发生化学反应”的结论。小亮的修改方案是_________。