题目内容
(2010?绵阳)在温度不变的条件下,下列欲使溶质的质量分数变为原来2倍的方法,最可行的是( )
【答案】分析:A、将20g硝酸钾饱和溶液蒸发掉10g水,蒸发水溶质硝酸钾析出,溶液仍为饱和溶液;一定温度下饱和溶液的溶质质量分数= ×100%;
×100%;
B、将20g硝酸钾不饱和溶液蒸发掉10g水,在不析出晶体时,蒸发水后溶液质量减小而溶质质量不变,由溶质质量分数公式判断蒸发后溶液的质量分数;
C、在10g10%的硝酸钾溶液中,加入5g40%的硝酸钾溶液,混合后溶液的质量为两溶液质量和、溶质质量为两溶液中溶质质量和,由溶质质量分数公式计算混合后溶液的质量分数;
D、将10g硝酸钾不饱和溶液中加入10g硝酸钾固体,能否全部溶解无法判断且原溶液的溶质质量分数不明确,无法确切得知所得溶液的溶质质量分数.
解答:解:A、在温度不变的条件下,将20g硝酸钾饱和溶液蒸发掉10g水,蒸发水溶质硝酸钾析出,溶液仍为饱和溶液;温度不变,硝酸钾的溶解度不变,饱和溶液的溶质质量分数不变;故A不可行;
B、将20g硝酸钾不饱和溶液蒸发掉10g水,在不析出晶体时,蒸发水后因溶液的质量减少一半而溶质质量不变,溶质质量分数增大一倍为原溶液的2倍;但若蒸发过程中有硝酸钾析出,则所得溶液质量分数将不能变为原溶液的2倍;故B不可行;
C、在10g10%的硝酸钾溶液中,加入5g40%的硝酸钾溶液,混合后溶液的溶质质量分数=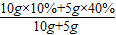 ×100%=20%,为原溶液10%的2倍;故C正确;
×100%=20%,为原溶液10%的2倍;故C正确;
D、因所加硝酸钾是否全部溶解不能确定而且原溶液的溶质质量分数也未明确,因此无法准确判断所得溶液的溶质质量分数;故D不可行;
故选C.
点评:对不饱和溶液蒸发掉原溶液质量的一半水时,若不析出固体,则溶液的溶质质量分数增大一倍.
 ×100%;
×100%;B、将20g硝酸钾不饱和溶液蒸发掉10g水,在不析出晶体时,蒸发水后溶液质量减小而溶质质量不变,由溶质质量分数公式判断蒸发后溶液的质量分数;
C、在10g10%的硝酸钾溶液中,加入5g40%的硝酸钾溶液,混合后溶液的质量为两溶液质量和、溶质质量为两溶液中溶质质量和,由溶质质量分数公式计算混合后溶液的质量分数;
D、将10g硝酸钾不饱和溶液中加入10g硝酸钾固体,能否全部溶解无法判断且原溶液的溶质质量分数不明确,无法确切得知所得溶液的溶质质量分数.
解答:解:A、在温度不变的条件下,将20g硝酸钾饱和溶液蒸发掉10g水,蒸发水溶质硝酸钾析出,溶液仍为饱和溶液;温度不变,硝酸钾的溶解度不变,饱和溶液的溶质质量分数不变;故A不可行;
B、将20g硝酸钾不饱和溶液蒸发掉10g水,在不析出晶体时,蒸发水后因溶液的质量减少一半而溶质质量不变,溶质质量分数增大一倍为原溶液的2倍;但若蒸发过程中有硝酸钾析出,则所得溶液质量分数将不能变为原溶液的2倍;故B不可行;
C、在10g10%的硝酸钾溶液中,加入5g40%的硝酸钾溶液,混合后溶液的溶质质量分数=
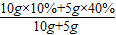 ×100%=20%,为原溶液10%的2倍;故C正确;
×100%=20%,为原溶液10%的2倍;故C正确;D、因所加硝酸钾是否全部溶解不能确定而且原溶液的溶质质量分数也未明确,因此无法准确判断所得溶液的溶质质量分数;故D不可行;
故选C.
点评:对不饱和溶液蒸发掉原溶液质量的一半水时,若不析出固体,则溶液的溶质质量分数增大一倍.

练习册系列答案
相关题目
(2010?绵阳)质量分数不同的硫酸溶液其密度不相同,对照表如下:
将10mL98%浓硫酸中加水稀释至100ml,取10mL该稀硫酸与足量锌反应制取氢气,请按要求完成系列问题的解答(计算结果保留一位小数):
(1)10mL98%的浓硫酸中含gH2SO4.
(2)列式计算消耗金属锌的质量.
(3)分析表中数据,可以归纳出硫酸溶液的质量分数与密度的关系是.10mL水和10mL质量分数为b%的硫酸溶液混合,混合后溶液的质量分数应该在至之间.
| 质量分数 | 10% | 20% | 30% | 40% | 50% | 60% | 70% | 80% | 90% | 98% |
| 密度(g/mL) | 1.07 | 1.14 | 1.22 | 1.30 | 1.40 | 1.50 | 1.61 | 1.73 | 1.81 | 1.84 |
(1)10mL98%的浓硫酸中含gH2SO4.
(2)列式计算消耗金属锌的质量.
(3)分析表中数据,可以归纳出硫酸溶液的质量分数与密度的关系是.10mL水和10mL质量分数为b%的硫酸溶液混合,混合后溶液的质量分数应该在至之间.
 CO+3H2.为了证实该反应所生成的混合气体的成分,兴趣小组的同学设计了如下图所示装置并进行实验,请你回答下列相关问题:
CO+3H2.为了证实该反应所生成的混合气体的成分,兴趣小组的同学设计了如下图所示装置并进行实验,请你回答下列相关问题: