题目内容
(2010?绵阳)(1)小李在学校实验室里,发现两瓶失去标签的溶液(标记为A、B),经询问实验员得知是稀硫酸和小苏打溶液.为了区分它们,小李进行了如下实验,请你协助他完成相关问题的解答:①向A、B两溶液中分别加入适量纯碱,观察到A中有大量气泡,B中没有明显变化现象.A溶液中发生反应的化学方程式是
.
②向A、B两溶液中分别投入生锈的铁钉,观察的到A溶液逐渐变为黄色,铁钉表面有气泡产生,B中没有明显变化现象.则A中所发生化学反应的类型有
③向A、B两溶液中分别加入盐酸,A中没有明显变化现象,B中的现象是
(2)A是一种常见液体,B是最清洁的燃料,它们与C、D、E、F几种物质按如图所示流程进行转化(部分反应条件略去),请按下列要求填空:
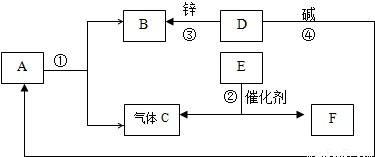
物质D的名称是,转化④中碱的化学式是
转化①的化学方程式是,
转化②的化学方程式是.
【答案】分析:(1)①根据碳酸钠能与硫酸反应生成硫酸钠、水和二氧化碳的性质,可由反应的现象判断A溶液为稀硫酸,写出反应的化学方程式;
②根据实验的现象查判断铁锈、铁钉都与稀硫酸发生了反应,由两个反应的特点判断反应的分类;
③根据小苏打为碳酸氢钠的俗称,利用含碳酸根的物质都可与盐酸反应放出二氧化碳的规律,判断所出现的现象;
(2)根据A是一种常见液体,B是最清洁的燃料,及A、B在框图中的关系,可确定A为水、B为氢气,同时可以确定气体C为氧气;然后根据金属与酸反应生成氢气、氯酸钾或过氧化氢催化分解生成氯化钾或水和氧气等知识,完成对框图中物质的推断,根据推断结果,回答所提出的问题.
解答:解:(1)①碳酸钠遇到硫酸发生反应,生成硫酸钠、水和气体二氧化碳,反应的化学方程式为H2SO4+Na2CO3=Na2SO4+CO2↑+H2O;
②铁锈的主要成分氧化铁与硫酸发生复分解反应,而铁钉与硫酸发生置换反应;
③小苏打碳酸氢钠遇到盐酸,反应生成氯化钠、水和二氧化碳,因此可观察到溶液中有气泡产生;
(2)由A是一种常见液体,B是最清洁的燃料,及A、B在框图中的关系,可确定A为水、B为氢气、C为氧气;根据D能与锌产生氢气,可判断D为盐酸或硫酸,而D与碱生成F,并且物质F为物质E在催化剂可生成氧气时的另一生成物,可判断F为氯化钾或水;若F为氯化钾则D为盐酸、E为氯酸钾、碱则为KOH,若F为水则E为过氧化氢、酸D可为盐酸可为硫酸、碱可为任意碱;
综合以上分析:物质D为稀盐酸(或稀硫酸),转化④中碱的为KOH(或其它任意碱),转化①为电解水,反应的化学方程式2H2O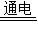 2H2↑+O2↑,转化②为氯酸钾的催化分解(或过氧化氢的催化分解),反应的化学方程式2KClO3
2H2↑+O2↑,转化②为氯酸钾的催化分解(或过氧化氢的催化分解),反应的化学方程式2KClO3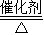 2KCl+3O2↑(或2H2O2
2KCl+3O2↑(或2H2O2 2H2O+O2↑);
2H2O+O2↑);
故答案为:(1)①H2SO4+Na2CO3=Na2SO4+CO2↑+H2O;②复分解反应、置换反应;③溶液中有气泡产生;
(2)稀盐酸;KOH;2H2O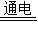 2H2↑+O2↑;2KClO3
2H2↑+O2↑;2KClO3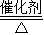 2KCl+3O2↑(或稀硫酸;KOH等;2H2O
2KCl+3O2↑(或稀硫酸;KOH等;2H2O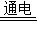 2H2↑+O2↑;2H2O2
2H2↑+O2↑;2H2O2 2H2O+O2↑).
2H2O+O2↑).
点评:解答本题时,对于最后的框图推断的解答,由于答案具有一定开放性且相互相关,因此,一定要使所给出的答案前后呼应.
②根据实验的现象查判断铁锈、铁钉都与稀硫酸发生了反应,由两个反应的特点判断反应的分类;
③根据小苏打为碳酸氢钠的俗称,利用含碳酸根的物质都可与盐酸反应放出二氧化碳的规律,判断所出现的现象;
(2)根据A是一种常见液体,B是最清洁的燃料,及A、B在框图中的关系,可确定A为水、B为氢气,同时可以确定气体C为氧气;然后根据金属与酸反应生成氢气、氯酸钾或过氧化氢催化分解生成氯化钾或水和氧气等知识,完成对框图中物质的推断,根据推断结果,回答所提出的问题.
解答:解:(1)①碳酸钠遇到硫酸发生反应,生成硫酸钠、水和气体二氧化碳,反应的化学方程式为H2SO4+Na2CO3=Na2SO4+CO2↑+H2O;
②铁锈的主要成分氧化铁与硫酸发生复分解反应,而铁钉与硫酸发生置换反应;
③小苏打碳酸氢钠遇到盐酸,反应生成氯化钠、水和二氧化碳,因此可观察到溶液中有气泡产生;
(2)由A是一种常见液体,B是最清洁的燃料,及A、B在框图中的关系,可确定A为水、B为氢气、C为氧气;根据D能与锌产生氢气,可判断D为盐酸或硫酸,而D与碱生成F,并且物质F为物质E在催化剂可生成氧气时的另一生成物,可判断F为氯化钾或水;若F为氯化钾则D为盐酸、E为氯酸钾、碱则为KOH,若F为水则E为过氧化氢、酸D可为盐酸可为硫酸、碱可为任意碱;
综合以上分析:物质D为稀盐酸(或稀硫酸),转化④中碱的为KOH(或其它任意碱),转化①为电解水,反应的化学方程式2H2O
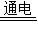 2H2↑+O2↑,转化②为氯酸钾的催化分解(或过氧化氢的催化分解),反应的化学方程式2KClO3
2H2↑+O2↑,转化②为氯酸钾的催化分解(或过氧化氢的催化分解),反应的化学方程式2KClO3 2KCl+3O2↑(或2H2O2
2KCl+3O2↑(或2H2O2 2H2O+O2↑);
2H2O+O2↑);故答案为:(1)①H2SO4+Na2CO3=Na2SO4+CO2↑+H2O;②复分解反应、置换反应;③溶液中有气泡产生;
(2)稀盐酸;KOH;2H2O
 2H2↑+O2↑;2KClO3
2H2↑+O2↑;2KClO3 2KCl+3O2↑(或稀硫酸;KOH等;2H2O
2KCl+3O2↑(或稀硫酸;KOH等;2H2O 2H2↑+O2↑;2H2O2
2H2↑+O2↑;2H2O2 2H2O+O2↑).
2H2O+O2↑).点评:解答本题时,对于最后的框图推断的解答,由于答案具有一定开放性且相互相关,因此,一定要使所给出的答案前后呼应.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(2010?绵阳)欲除去物质中所含少许杂质,所用的方法错误 的是( )
|
(2010?绵阳)质量分数不同的硫酸溶液其密度不相同,对照表如下:
将10mL98%浓硫酸中加水稀释至100ml,取10mL该稀硫酸与足量锌反应制取氢气,请按要求完成系列问题的解答(计算结果保留一位小数):
(1)10mL98%的浓硫酸中含gH2SO4.
(2)列式计算消耗金属锌的质量.
(3)分析表中数据,可以归纳出硫酸溶液的质量分数与密度的关系是.10mL水和10mL质量分数为b%的硫酸溶液混合,混合后溶液的质量分数应该在至之间.
| 质量分数 | 10% | 20% | 30% | 40% | 50% | 60% | 70% | 80% | 90% | 98% |
| 密度(g/mL) | 1.07 | 1.14 | 1.22 | 1.30 | 1.40 | 1.50 | 1.61 | 1.73 | 1.81 | 1.84 |
(1)10mL98%的浓硫酸中含gH2SO4.
(2)列式计算消耗金属锌的质量.
(3)分析表中数据,可以归纳出硫酸溶液的质量分数与密度的关系是.10mL水和10mL质量分数为b%的硫酸溶液混合,混合后溶液的质量分数应该在至之间.