题目内容
某同学欲测定草木灰中碳酸钾的含量,称取69 g试样于烧杯中,加入29.2g稀盐酸恰好完全反应,充分反应后,称得混合物的总质量为93.8 g(忽略二氧化碳的溶解对质量的影响)。请计算:
(1)反应过程中产生的二氧化碳质量为 g。
(2)该草木灰试样中碳酸钾的质量分数。
【温馨提示:K2CO3+2HCl=2KCl+H2O+CO2↑】
(1)反应过程中产生的二氧化碳质量为 g。
(2)该草木灰试样中碳酸钾的质量分数。
【温馨提示:K2CO3+2HCl=2KCl+H2O+CO2↑】
(1)4.4 (2)20%
(1)69g+29.2g-93.8g=4.4g 故答案为:4.4
(2)解:设试样中K2CO3的质量为x。
K2CO3+2HCl=2KCl+H2O+CO2↑
138 44
x 4.4g
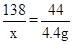 x=13.8g
x=13.8g
试样中K2CO3的质量分数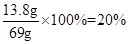
答:该试样中K2CO3的质量分数为20%
(2)解:设试样中K2CO3的质量为x。
K2CO3+2HCl=2KCl+H2O+CO2↑
138 44
x 4.4g
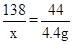 x=13.8g
x=13.8g试样中K2CO3的质量分数
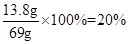
答:该试样中K2CO3的质量分数为20%

练习册系列答案
相关题目
 CaO + CO2 ↑ ,测得反应后固体的质量(m)与反应时间(t)的关系如下表:
CaO + CO2 ↑ ,测得反应后固体的质量(m)与反应时间(t)的关系如下表: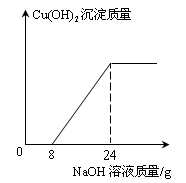
 Na2CO3+CO2↑+H2O, Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示。
Na2CO3+CO2↑+H2O, Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示。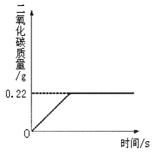
 12 CO2↑+ 10 H2O↑+ 6 X↑+ O2↑
12 CO2↑+ 10 H2O↑+ 6 X↑+ O2↑