题目内容
某硫酸钠样品中含有少量氯化钠。取15 g该样品于烧杯中,加入50 g水后完全溶解。向烧杯中滴加208.3 g氯化钡溶液,恰好完全反应,过滤、干燥,称得固体物质的质量为23.3 g。请计算
已知:BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
(1)硫酸钠样品中氯化钠的质量
(2)若将滤液的溶质质量分数变为10%,需蒸发掉水的质量
已知:BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
(1)硫酸钠样品中氯化钠的质量
(2)若将滤液的溶质质量分数变为10%,需蒸发掉水的质量
(1)0.8g ; (2)125g .
设:样品中硫酸钠的质量为x,生成氯化钠的质量为y。
BaCl2 + Na2SO4 BaSO4↓+ 2NaCl
142 233 117
x 23.3 g y
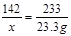
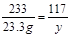
x =" 14.2" g y ="11.7" g
(1)样品中氯化钠的质量="15" g﹣14.2 g =" 0.8" g
(2)设蒸发水的质量为m。
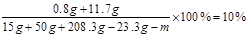
解得m= 125 g
答:(1)样品中氯化钠的质量为0.8 g;
(2)需蒸发掉水的质量为125 g。
BaCl2 + Na2SO4 BaSO4↓+ 2NaCl
142 233 117
x 23.3 g y
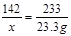
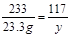
x =" 14.2" g y ="11.7" g
(1)样品中氯化钠的质量="15" g﹣14.2 g =" 0.8" g
(2)设蒸发水的质量为m。
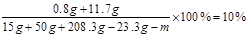
解得m= 125 g
答:(1)样品中氯化钠的质量为0.8 g;
(2)需蒸发掉水的质量为125 g。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目