题目内容
【题目】(1)如图所示是甲、乙、丙三种固体物质的溶解度曲线。
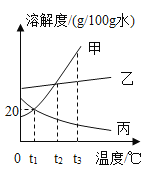
①t2 ℃时,甲、乙、丙三种物质的溶解度大小关系是_______________。
②t3 ℃时,甲、乙、丙三种物质的饱和溶液降温到t1 ℃,所得溶液中溶质质量分数的大小关系为_______________________。
③下列说法正确的是__________ (填序号)。
A.t1 ℃时,甲、丙两溶液的溶质质量分数一定相等。
B.t3 ℃时,向100 g20%甲的溶液中加100 g水,充分搅拌,溶液的溶质质量分数为10%。
C.t2 ℃时,升高丙溶液的温度,一定有晶体析出。
D.t3 ℃时,用等质量的甲、乙、丙分别配制成三种物质的饱和溶液,所需溶剂的质量为甲<乙<丙。
E.将t2 ℃时的甲和乙的饱和溶液降温到t1 ℃,析出晶体的质量甲大于乙。
F.甲中混有少量乙时可采取降温结晶的方法提纯得到甲
G.t1℃时,把15g固体甲放入50g水中,充分搅拌,所得溶液的质量是65g。
(2)生活中处处离不开化学,例如:
①我市森林公园是市民休闲锻炼的好去处,某同学对森林公园沟渠的水样进行了相关的研究,他可以采用_________ (填字母)来测沟渠水的酸碱度。
a.pH试纸 b.石蕊试液 c.酚酞试液 d.pH计
②开水瓶中的水垢(主要成分是氢氧化镁和碳酸钙),可用厨房的食醋(主要成分是CH3COOH)浸泡除去,已知除碳酸钙的化学方程是为CaCO3+2CH3COOH=(CH3COO)2Ca+H2O+CO2↑ 写出用食醋除氢氧化镁的化学方程式为___________。
③工业上常用氢氧化钠溶液吸收有毒气体二氧化硫,以防其污染空气,其化学方程式为__________。
【答案】 甲=乙>丙 乙>甲>丙 BDF ad Mg(OH)2+2CH3COOH=(CH3COO)2Mg+2H2O 2NaOH+SO2=Na2SO3+H2O
【解析】(1)由溶解度曲线可知,①t2 ℃时,甲、乙、丙三种物质的溶解度大小关系是甲=乙>丙
②由图可知,甲物质的溶解度随温度的升高而升高,当温度由t3 ℃时降温到t1 ℃,溶液有晶体析出,是t1 ℃的饱和溶液,乙物质的溶解度随温度的升高而升高,当温度由t3 ℃时降温到t1 ℃,溶液有晶体析出,是t1 ℃的饱和溶液,由图可知,t1 ℃时乙物质的溶解度大于甲物质的溶解度,故乙物质的质量分数大于甲物质的质量分数,丙物质的解度随温度的升高而降低,当温度由t3 ℃时降温到t1 ℃时,溶液变为不饱和溶液,溶液中的溶质的质量分数不变,故t3 ℃时,甲、乙、丙三种物质的饱和溶液降温到t1 ℃,所得溶液中溶质质量分数的大小关系为乙>甲>丙。
③A.t1 ℃时,甲、丙两溶液的饱和溶液溶质质量分数一定相等,错误。
B.t3 ℃时,100 g20%甲的溶液中溶质的质量为20g,当加入100 g水,充分搅拌,溶液的质量为200g,溶液中溶质的质量分数为![]() 。正确;
。正确;
C.t2 ℃时,升高丙溶液的温度,不一定有晶体析出,当原溶液是饱和溶液时升高温度才有晶体析出,错误。
D.t3 ℃时,甲、乙、丙三种物质的溶解度大小关系为丙<乙<甲,故用等质量的甲、乙、丙分别配制成三种物质的饱和溶液,所需溶剂的质量为甲<乙<丙,正确。
E.甲物质的溶解度随温度的变化较大,乙物质的溶解度随 温度的变化较小,故t2 ℃时的甲和乙的溶解度相等,故等质量的甲乙饱和溶液降温到t1 ℃,析出晶体的质量甲大于乙,析出晶体的质量与原饱和溶液的质量有关,错误。
F.甲中混有少量乙时可采取降温结晶的方法提纯得到甲,正确;
G.t1℃时,甲物质的溶解度为20个,故把15g固体甲放入50g水中,充分搅拌不能完全溶解,所得溶液的质量小于65g,错误。故选BDF。
(2)①pH试纸和pH计都可以测定溶液的pH,故选ad;②食醋与氢氧化镁的化学方程式为Mg(OH)2+2CH3COOH=(CH3COO)2 Mg +2H2O;③氢氧化钠与二氧化硫反应生成亚硫酸钠和水,反应方程式为2NaOH+SO2===Na2SO3+H2O;

 名校课堂系列答案
名校课堂系列答案