题目内容
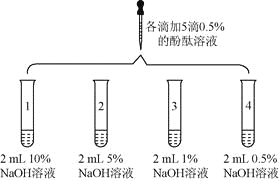
【题目】(6分)众所周知,酚酞溶液遇![]() 溶液变红。但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物。
溶液变红。但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物。
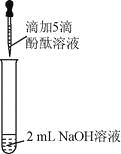
【提出问题】分组实验中,出现意想不到的现象的原因是什么呢?
【查阅资料】酚酞溶液由酚酞固体溶于酒精配制而成。
【猜想与假设】
Ⅰ.红色褪去,与![]() 溶液和空气中的
溶液和空气中的![]() 反应有关。
反应有关。
Ⅱ.红色褪去,与NaOH溶液的浓度有关。
Ⅲ.出现白色浑浊物,与酚酞溶液的浓度有关。
【进行实验】
实验 | 实验操作 | 实验现象 | |
1 | 向盛有2 mL | 溶液变红 | |
2 |
| 1号试管 | |
3 | 取3支试管,分别加入2 mL水,…… | 酚酞溶液浓度/% | 浑浊程度] |
5 | 大量浑浊物 | ||
2 | 少量浑浊物 | ||
| 无浑浊物 | ||
【解释与结论】
(1)![]() 与
与![]() 反应的化学方程式为 。
反应的化学方程式为 。
(2)实验1的现象表明,猜想与假设1 (填“成立”或“不成立”)。
(3)由实验2得出结论:出现“溶液变红后褪色”现象的原因是 。
(4)实验3的操作步骤:取3支试管,分别加入![]() 水, 。
水, 。
【反思与评价】
(5)依据现有实验,为了确保红色不变,若酚酞溶液浓度为![]() ,建议选用NaOH溶液的浓度为 %。
,建议选用NaOH溶液的浓度为 %。
(6)有同学认为,仅通过实验3得出“猜想与假设Ⅲ成立”证据不足,理由是 。
【答案】(1)2NaOH + CO2="=" Na2CO3+ H2O (2)不成立
(3)与NaOH浓度有关,浓度过高会使酚酞褪色
(4)分别向三支试管中滴加5滴5%,2%,0.5%的酚酞溶液
(5)0.5% (6)没有控制NaOH溶液的浓度相等
【解析】试题(1)NaOH与CO2反应的化学方程式为:2NaOH + CO2="=" Na2CO3+ H2O
(2)实验1的现象表明,即使是NaOH溶液与CO2反应生成碳酸钠,碳酸钠溶液也能使无色酚酞溶液变红,故猜想与假设1不成立
(3)由实验2NaOH浓度越大,酚酞溶液就越快褪色,故得出结论:出现“溶液变红后褪色”现象的原因是与NaOH浓度有关,浓度过高会使酚酞褪色
(4)根据实验3的实验现象,故实验3的操作步骤:取3支试管,分别加入2mL水,分别向三支试管中滴加5滴5%,2%,0.5%的酚酞溶液
(5)根据实验2中的试管4的实验现象,为了确保红色不变,若酚酞溶液浓度为![]() ,建议选用NaOH溶液的浓度为0.5%
,建议选用NaOH溶液的浓度为0.5%
(6)实验3中没有控制NaOH溶液的浓度相等,故仅通过实验3得出“猜想与假设Ⅲ成立”证据不足,理由是没有控制NaOH溶液的浓度相等

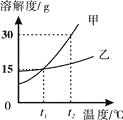
【题目】依据下列实验和数据回答下列小题。
向100 g水中加入固体A或改变温度,得到相应的溶液①~③。
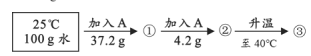
资料:A的溶解度 | |||
温度/℃ | 20 | 30 | 40 |
溶解度/g | 37.2 | 41.4 | 45.8 |
【1】在通常情况下,下列溶液中一般得不到饱和溶液的是
A. 硝酸钾溶液B. 二氧化碳溶液C. 酒精溶液D. 氯化钠溶液
【2】下列说法中,正确的是
A. 配制溶液时,搅拌可以增大固体溶质的溶解度
B. 金属与酸溶液发生置换反应后,溶液质量一定增加
C. 不饱和溶液变为饱和溶液,溶质质量分数一定变大
D. 有单质和化合物生成的反应一定是置换反应