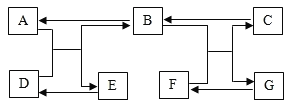
题目内容
【题目】镓是一种奇妙的金属,放在手心马上熔化就如荷叶上的水珠流来流去,请回答:
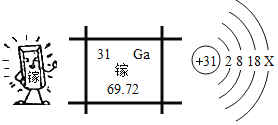
(1)镓可以做高温温度计,用微粒的观点解释温度计示数改变的原因是____________。
(2)镓元素与氧元素形成化合物的化学式为______________。
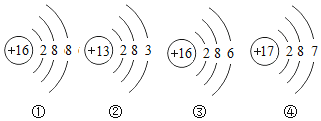
(3)上面是四种粒子的结构示意图,其中与镓同属于金属原子的是__________(填序号)。
【答案】镓原子间存在间隔,间隔随温度变化而变化 Ga2O3 ②
【解析】
(1)镓可以做高温温度计,原因是镓原子间存在间隔,间隔随温度变化而变化。
(2)镓元素原子最外层电子数为![]() ,化学反应中易失去3个电子,带3个单位正电荷,常现+3价,氧元素的化合价为-2价,设镓元素与氧元素形成化合物的化学式为
,化学反应中易失去3个电子,带3个单位正电荷,常现+3价,氧元素的化合价为-2价,设镓元素与氧元素形成化合物的化学式为![]() ,根据最小公倍数法,该化合物中化合价绝对值的最小公倍数为6,则:
,根据最小公倍数法,该化合物中化合价绝对值的最小公倍数为6,则:![]() ,所以化合物的化学式为
,所以化合物的化学式为![]()
(3)四种粒子的结构示意图分别为硫离子、铝原子、硫原子和氯原子,从名称判断,其中与镓同属于金属原子的是铝原子,选择②。

【题目】小明在某食品包装袋内发现有一个装有白色颗粒状固体的小纸袋,上面写着(干燥剂,主要成分为生石灰)小明将小纸袋放在空气中,一段时间后,发现纸袋内的白色颗粒黏在一起成为块状。他把块状固体拿到实验室和同学们一起进行实验探究。
(1)请你帮助他们完成实验探究的方案:
实验操作 | 预测实验现象 | 实验结论 | 原因解释 |
①取少量块状固体于试管中,加热至高温,并将生成气体通入澄清石灰水中 | ___ | 有碳酸钙 | 试管中发生的反应方程式为____ |
②另取少量块状固体于试管中,加适量水振荡,静置后,向上层清液中滴加酚酞试液。 | ___ | 块状固体中含有氢氧化钙 |
(2)对这个实验方案①,有同学提出了问题,为什么块状固体中会有碳酸钙呢?请你用方程式做出解释___。
(3)对实验方案②,小明提出了质疑,认为这个实验结论不准确,理由是_____。
【题目】实验室在做有关CO2的性质实验中,用氢氧化钠溶液吸收CO2,而不用澄清石灰水,小喵同学想用以下A、B两组对比试验进行验证(实验后立即盖紧瓶盖并振荡);

(1)上述对比实验,除了观察到B中变浑浊,通过______现象说明了氢氧化钠溶液吸收CO2的效果更好。
(2)将上述反应后的物质混合,发现白色固体增多。为了处理反应后的废液,过滤后对废液的成分进行分析;
(提出问题)废液溶质的成分是什么?
(作出猜想)猜想一:溶质为NaOH
猜想二:溶质为_________________;
猜想三:溶质为NaOH和Na2CO3;
(设计实验)为验证猜想,请完成下列实验报告。
实验方案 | 实验现象 | 实验结论 |
方案一:取少量滤液于试管中,滴加少量稀硫酸 | 无气泡产生 | 猜想三不成立 |
方案二:取少量滤液于试管中,滴加几滴氯化钙溶液 | _________________ | 猜想三成立 |
(讨论交流)小亮同学认为上述实验方案一稀硫酸量不足,请写出导致实验没有产生气泡的原因是____________________________(用化学方程式表示)。
(反思与评价)
(1)实验室可将浓硫酸稀释得到稀硫酸,稀释时应将___________(选填“浓硫酸”或“水”)沿容器壁慢慢注入另一液体中,并不断搅拌。
(2)将上述废液直接排放会造成污染,应进行的处理措施是____________________。
【题目】实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下 “Na”和“10%”字样。已知它是![]() 中的一种。小强和小华同学决定对其成分进行探究。
中的一种。小强和小华同学决定对其成分进行探究。

(提出问题)这瓶试剂可能是什么溶液呢?
(交流讨论)根据受损标签的情况判断,这瓶试剂不可能是________;
A 酸 B 碱 C 盐
(查阅资料)Ⅰ. Na2CO3和NaHCO3溶液都呈碱性。
Ⅱ. 测定室温(20℃)时,四种物质的溶解度的数据如下
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度g | 36 | 109 | 215 | 9.6 |
(得出结论)小华根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是________;理由是________;
(探究)(1)小强用pH计测得该溶液样品的pH=12.5,这瓶试剂不可能是________;
(2)小强为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验:
操作步骤 | 实验现象 | 结论及化学方程式 |
1.取样于试管中,滴加足量的______溶液 | 有白色沉淀 | 该瓶试剂为变质的氢氧化钠溶液 |
2.静置,取上层清液滴加_______溶液 | _____________ |