题目内容
【题目】某实验小组模拟高炉炼铁的化学反应原理设计了用一氧化碳还原氧化铁的实验装置,如图所示:
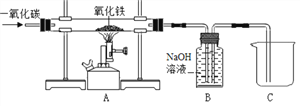
(提出问题)(1)实验所用的氧化铁完全反应后,玻璃管中剩余的黑色固体成分。
(2)反应后由B装置排到烧杯C中的溶液所含溶质的成分。
(查阅资料)
常见铁和铁的氧化物 | Fe | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 能 | 否 | 否 | 能 |
(探究1)玻璃管中剩余的黑色固体成分。
(初步验证)玻璃管中剩余固体为黑色,能全部被磁铁吸引。
实验小组的同学一致认为,黑色固体不可能是FeO和Fe2O3,理由是______。
(作出猜想)黑色固体可能:a.全部是Fe;b.全部是Fe3O4;c._______。
(设计实验)为确定黑色固体的成分,同学们设计了下列实验方案,请你一起参与探究活动。
实验操作 | 实验现象 | 实验结论 |
取少量黑色固体于试管中,加入_______ | ______ | 黑色固体全部是Fe3O4 |
(探究2)反应后由B装置排到烧杯C中的溶液所含溶质的成分。写出B装置中NaOH发生反应的化学方程式:_______
(作出猜想)猜想一:溶质是Na2CO3;猜想二:溶质是_______;
(设计实验)
实验操作 | 实验现象 | 实验结论 |
(1)取少量溶液于试管中,加入__________; | 产生白色沉淀 | 该反应的化学方程式为__________ |
(2)将(1)反应后的混合物过滤,取滤液加入________ | ___________ | 猜想一成立 |
(反思与交流)(1)B装置除了吸收CO2气体外,还有的作用是______;
(2)为了避免加热玻璃管时可能发生爆炸,在加热前应________。
【答案】 FeO、Fe2O3不能被磁铁吸引 Fe和Fe3O4的混合物 稀盐酸/稀硫酸 没有气泡产生 CO2+2NaOH=Na2CO3+H2O NaOH和Na2CO3 过量的CaCl2溶液 CaCl2+Na2CO3=CaCO3↓+2NaCl 无色酚酞试液 溶液不变红 收集多余的CO,防止污染大气 先通CO,排尽装置内的空气
【解析】本题考查了一氧化碳还原氧化铁后剩余固体成份的探究,金属、碱、盐的性质。掌握铁和铁的氧化物的性质以及尾气的处理等知识点是解答的基础。
探究1:初步验证:根据表格中信息可知FeO和Fe2O3不能被磁铁吸引,实验中黑色粉末能被磁铁全部吸引,说明不含这两种物质;
作出猜想:根据剩余固体可能是铁出可能是四氧化三铁,还可能是二者的混合物,所以猜想c是Fe和Fe3O4的混合物;
设计实验:若黑色固体全部是Fe3O4,黑色固体中没有铁,加入稀盐酸(或稀硫酸)没有气泡产生;
探究2:一氧化碳与氧化铁在高温条件下生成铁与二氧化碳。氢氧化钠溶液与二氧化碳反应生成碳酸钠和水,反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O;
作出猜想:氢氧化钠溶液与二氧化碳反应生成碳酸钠和水。如完全反应溶液中的溶质只有Na2CO3,氢氧化钠溶液如没有完全反应,则溶液中的溶质有NaOH和Na2CO3两种,所以猜想二的溶质是NaOH和Na2CO3;
设计实验:碳酸钠能和氯化钙反应生成白色沉淀,反应后溶液显中性;如加入氯化钙后溶液仍显碱性,说明原溶液中除了碳酸钠溶质外还含有氢氧化钠,检验溶液显碱性常用无色酚酞溶液,能使无色酚酞溶液变红,说明溶液显碱性;因此:
实验操作 | 实验现象 | 实验结论 |
(1)取少量溶液于试管中,加入过量的CaCl2溶液; | 产生白色沉淀 | 该反应的化学方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl |
(2)将(1)反应后的混合物过滤,取滤液加入无色酚酞试液 | 溶液不变红 | 猜想一成立 |
反思与交流:(1)根据尾气中除了二氧化碳外还有一氧化碳,要进行处理,所以装置B除了吸收二氧化碳外还有收集多余的CO,防止污染大气;
(2)一氧化碳与空气混合有发生爆炸的危险,实验前要先通CO,排尽装置内的空气再进行加热。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案