题目内容
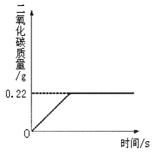
将2.34gNaCl固体溶于103.4g水中得到不饱和溶液,再向所得溶液中小心滴入200g AgNO3溶液.实验过程中,生成的AgCl的质量与滴入的AgNO3溶液的质量关系如图所示(提示:NaCl+AgNO3=AgCl↓+NaNO3).

(1)计算A点处生成NaNO3的质量?
(2)计算B点溶液中AgNO3的溶质质量分数。

(1)计算A点处生成NaNO3的质量?
(2)计算B点溶液中AgNO3的溶质质量分数。
(1)3.4g (2)2.3%
(1)由图像可知,当加入100g AgNO3溶液时,NaCl与恰好完全反应,设此时生成NaNO3的质量为x,生成AgCl的质量为y,消耗溶质AgNO3质量为z,得
NaCl+AgNO3=AgCl↓+NaNO3
58.5 170 143.5 85
2.34g z y x
(1) 58.5:85=2.34g:x 解得 x=3.4g
(2) 58.5:143.5=2.34g:y 解得 y=5.74g
58.5:170=2.34g:z 解得 z=6.8g
由于溶液具有均一性,所以到A处硝酸银溶液中含有6.8g硝酸银,则B点的继续滴加的溶液中的硝酸银也是6.8g.
B点溶液的质量=2.34g+103.4g+200g-5.74g=300g
B点溶液AgNO3的溶质质量分数=6.8g/300g×100%≈2.3%
答:A点处生成NaNO3的质量为3.4g,B点溶液AgNO3的溶质质量分数为2.3%.
NaCl+AgNO3=AgCl↓+NaNO3
58.5 170 143.5 85
2.34g z y x
(1) 58.5:85=2.34g:x 解得 x=3.4g
(2) 58.5:143.5=2.34g:y 解得 y=5.74g
58.5:170=2.34g:z 解得 z=6.8g
由于溶液具有均一性,所以到A处硝酸银溶液中含有6.8g硝酸银,则B点的继续滴加的溶液中的硝酸银也是6.8g.
B点溶液的质量=2.34g+103.4g+200g-5.74g=300g
B点溶液AgNO3的溶质质量分数=6.8g/300g×100%≈2.3%
答:A点处生成NaNO3的质量为3.4g,B点溶液AgNO3的溶质质量分数为2.3%.

练习册系列答案
相关题目
 Na2CO3+CO2↑+H2O, Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示。
Na2CO3+CO2↑+H2O, Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示。