题目内容
【题目】实验室有一瓶标签腐蚀的溶液A(如图),某组同学将碳酸钠溶液与样品反应,有白色沉淀产生,过滤后得到澄清滤液,同学们进行了一系列的探究。

探究一:A溶液中溶质是什么?
【提出猜想】①CaCl2,②_________________。
【查阅资料】CaCl2溶液呈中性。
【设计实验】同学们设计了如下方案并进行实验。
实验操作 | 实验现象 | 实验结论 |
取少量A溶液于试管中,向其中滴加无色酚酞溶液 | _______________________ | 猜想①正确 |
碳酸钠与其反应的化学方程式为_______________________________________。
探究二:过滤后的滤液中会有哪些溶质?
【提出猜想】小明的猜想:NaCl、CaCl2;
小红的猜想:NaCl;
你的猜想:_________________________。
【设计实验】请设计对“你的猜想”实验:
实验步骤 | 实验现象 | 实验结论 |
_______ | ___________ | 你的猜想正确 |
【答案】 Ca(OH)2 溶液不变色 Na2CO3+CaCl2═CaCO3↓+2NaCl NaCl和Na2CO3 取少量过滤后的滤液于试管中,向其中滴入稀盐酸 有气泡产生
【解析】探究一【提出猜想】根据标签是“化钙”,常见的是:氢氧化钙(溶液显碱性)、氯化钙(溶液显中性)分析解答;【设计实验】根据猜想①正确可知,A溶液中溶质是CaCl2,CaCl2不能使无色酚酞溶液变色解答;根据碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠解答;探究二【提出猜想】根据反应物是否过量分析;【设计实验】根据滤液中有碳酸钠可以向其中加入稀盐酸,有气泡产生分析解答。探究一【提出猜想】标签是“化钙”,常见的是:氢氧化钙(溶液显碱性)、氯化钙(溶液显中性),故猜想②是Ca(OH)2;【设计实验】由猜想①正确可知,A溶液中溶质是CaCl2,CaCl2不能使无色酚酞溶液变色,故现象为溶液不变色;碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,反应的化学方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl;探究二【提出猜想】反应中有可能是碳酸钠过量,故猜想为NaCl和Na2CO3;【设计实验】取少量过滤后的滤液于试管中,向其中滴入稀盐酸,有气泡产生,说明猜想正确。

 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】为探究锌、铜、铬三种金属的性质,某兴趣小组进行如下实验。
【实验一】将三种金属丝分别与一节干电池和小电珠连接,小电珠发光。
【实验二】取粗细、长短相同的锌丝、铜丝、铬丝均与50mL稀硫酸反应,实验记录如下:
锌 | 铜 | 铬 | 铜 | |
稀硫酸的质量分数 | 5% | 5% | 15% | 15% |
反应现象 | 少量气泡 | 无现象 | 许多气泡 | 无现象 |
【实验三】金属锌、铜和稀硫酸构成如图所示的化学电池装置,观察到铜片表面有气泡(H2),小电珠发光。
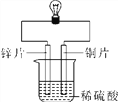
(1)实验一的现象说明三种金属都具有____________性;
(2)铬与稀硫酸反应生成硫酸亚铬(CrSO4)和氢气,反应的化学方程式是______________________________________;该反应属于________________(填基本反应类型)反应;
(3)要判断三种金属活动性强弱,必须在实验二的基础上增补一个实验才能得出结论,其实验内容是把粗细、长短相同的________________放入________________的50mL稀硫酸中,观察放出气泡的快慢;
(4)金属活动性强弱是由金属物质的结构决定的,不会因某个实验而改变。下列关于实验三分析正确的是______(填序号)。
A.铜的金属活动性变得比锌强
B.铜与稀盐酸发生了置换反应
C.该装置将化学能转化为电能