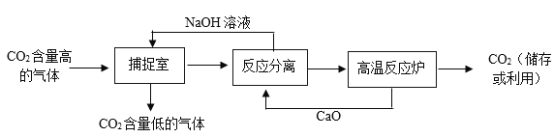
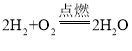题目内容
【题目】铝、铁、铜是生活中常见的金属。
(1)铝、铁、铜三种金属都能作导线,是因为它们都具有______。
(2)铝在空气中不易被锈蚀,是因为______![]() 用化学方程式表示
用化学方程式表示![]() 。
。
(3)铜锈的主要成分为碱式碳酸铜Cu2(OH)2CO3,由此我们可以得到铜生锈是铜和氧气、水、______共同作用的结果。
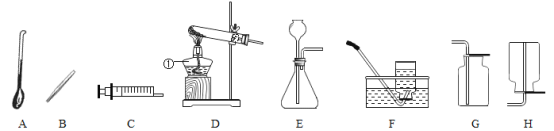
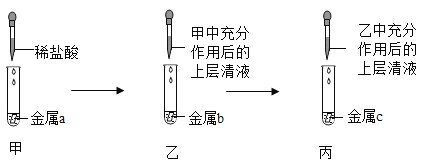
(4)某同学用如图所示装置,设计实验验证铝、铁、铜三种金属活动性强弱。![]() 每步反应金属均有剩余
每步反应金属均有剩余![]() 若甲试管中无明显现象,乙试管中的金属b为______时可以验证三种金属活动性强弱,丙试管中反应的化学方程式为______若金属a、b、c依次为铁、铝、铜时,则无法比较______和______的活动性强弱。
若甲试管中无明显现象,乙试管中的金属b为______时可以验证三种金属活动性强弱,丙试管中反应的化学方程式为______若金属a、b、c依次为铁、铝、铜时,则无法比较______和______的活动性强弱。
【答案】导电性 ![]() 二氧化碳 铁
二氧化碳 铁 ![]() 铁 铜
铁 铜
【解析】
(1)铝、铁、铜三种金属都能作导线,是因为它们都具有导电性。
(2)铝在空气中不易被锈蚀,是因为易被氧气氧化生成致密的氧化铝保护膜,化学方程式:4Al+3O2=2Al2O3。
(3)铜锈的主要成分为碱式碳酸铜[Cu2(OH)2CO3],铜锈中含有铜、氢、氧和碳元素,根据质量守恒定律,由此我们可以得到铜生锈需要含有氢元素、氧元素和碳元素的物质,空气中含有氢元素的物质是水,含有碳元素的物质是二氧化碳,故是铜和氧气、水和二氧化碳共同作用的结果。
(4)金属活动性顺序为铝>铁>铜。若甲试管中无明显现象,则甲中是铜,上层清夜是盐酸,可以与铁反应生成氯化亚铁,氯化亚铁能与铝反应生成氯化铝和铁,故乙试管中的金属b为铁时可以验证三种金属活动性强弱,丙试管中反应的化学方程式为2Al+3FeCl2=2AlCl3+3Fe;
若金属a、b、c依次为铁、铝、铜时,a中铁与盐酸反应生成氯化亚铁,氯化亚铁与b中的铝反应生成氯化铝和铁,可以证明铁和铝的活动性,铝>铁,氯化铝不与c中的铜反应,可以知道铝和铜的活动性,铝>铜,所以无法比较铁和铜的活动性强弱。

 阅读快车系列答案
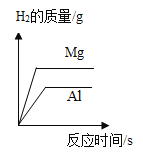
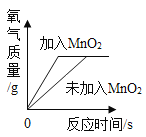
阅读快车系列答案【题目】影响化学反应速率的因素很多。下列图像表达的化学反应过程,与实际情况不相符的是( )
选项 | A | B | C | D |
化学反应 | 等质量的镁片和铝片分别与足量相同的稀硫酸反应 | 等质量相同的过氧化氢溶液分别在有、无 | 等质量不同浓度的盐酸分别与足量相同的锌片反应 | 等质量形状不同的大理石分别与足量相同的稀盐酸反应 |
图像 |
|
|
|
|
A.AB.BC.CD.D
【题目】酸有相似的化学性质,碱也有相似的化学性质,当将氢氧化钠溶液和稀盐酸混合时,却没有看到明显现象。
[提出问题]氢氧化钠溶液与稀盐酸是否发生化学反应?
[查阅资料] 酸与碱发生中和反应会放出热量。
[实验设计] 甲、乙、丙三位同学分别设计了实验方案,请你帮他们完成实验报告。
同学 | 实验操作 | 现象 |
甲 | 将稀盐酸慢慢滴入加有酚酞的NaOH 溶液中,并不断搅拌 | 溶液颜色的变化是_________ |
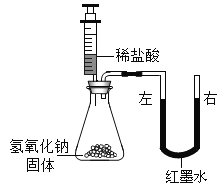
乙 |
| U型玻璃管中__________边的红墨水液面下降(所加稀盐酸的体积忽略不计) |
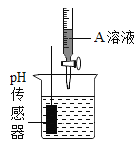
丙 | 用pH传感器测量反应过程中溶液pH值的变化情况 。 | 实验过程中, 不断搅拌得到的烧杯中溶液PH值变化曲线。
|
[结论]氢氧化钠与稀盐酸发生了化学反应。
(1) 氢氧化钠与盐酸反应的化学方程式为_______________________。
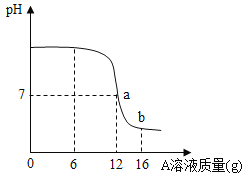
(2) 丙同学实验中,根据pH曲线判断,当加入A溶液____(填名称) 的质量为_______________g时, 反应恰好完全进行。
(3)丙同学实验中,当加入l6g A溶液时,烧杯中溶液的溶质是_______________________。
[反思]后来,同学们一致认为乙方案不够合理,理由是_______________________。