题目内容
【题目】酸有相似的化学性质,碱也有相似的化学性质,当将氢氧化钠溶液和稀盐酸混合时,却没有看到明显现象。
[提出问题]氢氧化钠溶液与稀盐酸是否发生化学反应?
[查阅资料] 酸与碱发生中和反应会放出热量。
[实验设计] 甲、乙、丙三位同学分别设计了实验方案,请你帮他们完成实验报告。
同学 | 实验操作 | 现象 |
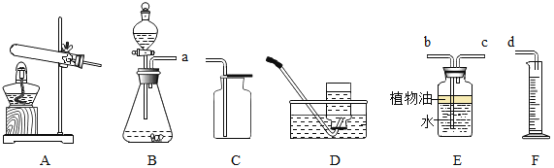
甲 | 将稀盐酸慢慢滴入加有酚酞的NaOH 溶液中,并不断搅拌 | 溶液颜色的变化是_________ |
乙 |
| U型玻璃管中__________边的红墨水液面下降(所加稀盐酸的体积忽略不计) |
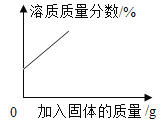
丙 | 用pH传感器测量反应过程中溶液pH值的变化情况 。 | 实验过程中, 不断搅拌得到的烧杯中溶液PH值变化曲线。
|
[结论]氢氧化钠与稀盐酸发生了化学反应。
(1) 氢氧化钠与盐酸反应的化学方程式为_______________________。
(2) 丙同学实验中,根据pH曲线判断,当加入A溶液____(填名称) 的质量为_______________g时, 反应恰好完全进行。
(3)丙同学实验中,当加入l6g A溶液时,烧杯中溶液的溶质是_______________________。
[反思]后来,同学们一致认为乙方案不够合理,理由是_______________________。
【答案】溶液从红色变为无色 左 ![]() 。 稀盐酸 12 NaCl、HCl 氢氧化钠固体溶于水也会放出热量
。 稀盐酸 12 NaCl、HCl 氢氧化钠固体溶于水也会放出热量
【解析】
实验设计:甲:将稀盐酸慢慢滴入加有酚酞的NaOH 溶液中,并不断搅拌,氢氧化钠显碱性,能使无色酚酞试液变红,加入稀盐酸,氢氧化钠与稀盐酸反应生成氯化钠和水,氯化钠显中性,盐酸显酸性,均不能使无色酚酞试液变红,故溶液颜色的变化是:溶液从红色变为无色;
乙:向氢氧化钠固体中加入稀盐酸,氢氧化钠与稀盐酸反应放出热量,故装置内气体受热膨胀,压强增大,在压强差的作用下,U型玻璃管中左边的红墨水液面下降;
结论:(1)氢氧化钠与稀盐酸反应生成氯化钠和水,该反应的化学方程式为:![]() ;
;
(2)由pH曲线图可知,一开始,溶液的pH>7,说明溶液显碱性,随着反应的进行,pH逐渐减小至小于7,故该反应是将稀盐酸加到氢氧化钠溶液中;
由图可知,当加入稀盐酸的质量为12g时,pH=7,说明恰好完全反应;
(3)由图可知,当加入l6g A溶液时,pH<7,说明这时稀盐酸过量,氢氧化钠与稀盐酸反应生成氯化钠和水,故烧杯中溶液的溶质是:NaCl、HCl;
反思:氢氧化钠固体溶于水,也会放出大量的热,也会出现相同的实验现象,故乙方案不够合理。