��Ŀ����
����Ŀ��ijͬѧΪ�˲ⶨ������пƬ��п�ĺ�����ȡ��ͬ������пƬ���η���ʢ��ϡ������ձ��У���Ӧ��ȫ��Ƴ����������ʲ��μӷ�Ӧ��Ҳ������ˮ����ʵ������¼���£�
���� | 1 | 2 | 3 | 4 | 5 | 6 |
�����������g�� | 20 | 40 | 60 | 80 | 100 | 120 |
ϡ�����������g�� | 200 | 200 | 200 | 200 | 200 | 200 |
�ձ������ʵ���������g�� | 219.6 | _____ | 258.8 | 278.4 | _____ | 318.4 |
��1������2�κ͵�5��ʵ����ձ���ʣ�����ʵ������������ϱ��У�
��2��ʵ��������пƬ��п����������Ϊ_____��
��3����ʵ����ʹ�õ�ϡ�����������������Ϊ_____������������ȷ��0.1%��
���𰸡�239.2 298.4 65% 39.2%
��������
��1����ͼ����Ϣ��֪��ÿ����20gп����0.4g������ʵ��2�м���40gп����0.8g���������ձ������ʵ�������Ϊ40g+200g-0.8g=239.2g��ʵ��4�м���80gп������������Ϊ80g+200g-278.4g=1.6g��ʵ��6�м���120gп��������������Ϊ120g+200g-318.4g=1.6g��˵��ʵ��4�ɺ���ȫ��Ӧ��ʵ��5��ͬ������1.6g����������ʵ��5�ձ������ʵ�������Ϊ100g+200g-1.6g=298.4g�����239.2��298.4��
��2���裺п������Ϊx�����������y
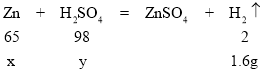
![]()
x��52g
![]()
y��78.4g
��пƬ��п����������Ϊ![]() ��100%��65%��
��100%��65%��
��3��ϡ�����������������Ϊ![]() ��100%��39.2%��
��100%��39.2%��