题目内容
【题目】某工厂排出的废水中含有硝酸银,为了回收废水中的贵金属银,设计了如下工艺流程。

(1)操作Ⅰ、Ⅱ的名称是_______________________,气体C的化学式是_____________________。
(2)固体A的成分是______________________。
(3)若往溶液D中加人适量的氧化锌,可得到只含有一种溶质的溶液,试写出发生反应的化学方程式__________________。
【答案】过滤 H2 Zn和Ag ![]()
【解析】
锌的金属活动性比银的金属活动性强,固体A的成分有反应生成的银和过量的锌,气体C是锌和稀硫酸反应生成的氢气,氢气的化学式是H2。硝酸银和锌反应生成硝酸锌和银;稀硫酸和锌反应生成硫酸锌和氢气,稀硫酸和氧化锌反应生成硫酸锌和水。
(1)操作I、Ⅱ是将固体和液体进行分离的操作,故名称是过滤;气体C是过量锌和稀硫酸反应生成的氢气,氢气的化学式是H2。
(2)由上分析可知固体A的成分有反应生成的银和过量的锌,故填:Zn和Ag。
(3)氧化锌和稀硫酸反应生成硫酸锌和水,若往溶液D中加人适量的氧化锌,可得到只含有一种溶质硫酸锌的溶液,发生反应的化学方程式为:![]() 。
。

【题目】某同学为了测定不纯的锌片中锌的含量,取不同质量的锌片依次放入盛有稀硫酸的烧杯中,反应完全后称出质量(杂质不参加反应,也不溶于水)。实验结果记录如下:
次数 | 1 | 2 | 3 | 4 | 5 | 6 |
加入锌的质量(g) | 20 | 40 | 60 | 80 | 100 | 120 |
稀硫酸的质量(g) | 200 | 200 | 200 | 200 | 200 | 200 |
烧杯中物质的总质量(g) | 219.6 | _____ | 258.8 | 278.4 | _____ | 318.4 |
(1)将第2次和第5次实验后烧杯中剩余物质的总质量填在上表中;
(2)实验中所用锌片中锌的质量分数为_____;
(3)该实验所使用的稀硫酸的溶质质量分数为_____。(计算结果精确到0.1%)
【题目】研究小组设计下列实验方案探究CO2与NaOH溶液是否发生反应。
方案一:
[查阅资料]
①乙醇不与NaOH、Na2CO3、CO2反应;
②25℃时,NaOH和Na2CO3在乙醇中的溶解度如下表:
物质 | NaOH | Na2CO3 |
溶解度/g | 17.3 | <0.01 |
[实验装置] 如图1。
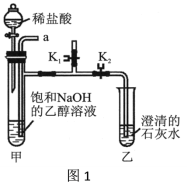
[实验步骤]
i.打开K1,关闭K2,从导管口a通入CO2气体,直至观察到饱和NaOH的乙醇溶液中产生大量沉淀,停止通CO2;
ii.从导管口a通入足量氮气;
iii.关闭K1,打开K2,向装置甲的试管中滴入足量的稀盐酸,观察装置乙的现象。
(1)步骤i产生沉淀的原因是___________________。
(2)步骤ii的目的是____________________。
(3)步骤iii装置乙中产生现象的原因是__________(用化学方程式表示)。
方案二:
[实验装置]
如图2(三颈瓶内集满CO2气体;装药品后的注射器B的活塞用夹子固定)。
[实验步骤]
按以下步骤完成实验,通过相对压强传感器测量瓶内压强的变化。整个实验过程的压强随时间变化如图3。
i.将注射器A内的NaOH溶液注入瓶中,测量压强直至不再改变;
ii.取下夹子,将注射器B内的盐酸注入瓶中,测量压强直至不再改变;
iii.将两个注射器的活塞都拉回原位,并都用夹子固定,测量压强直至不再改变。
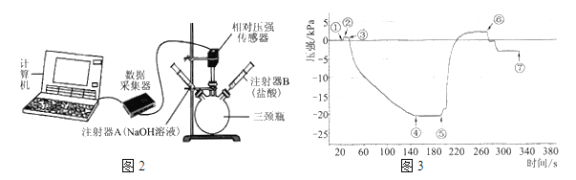
(4)检查图2装置气密性的方法:____________。
(5)为缩短①→④中反应的时间,可采取的操作是______________。
(6)写出导致⑤→⑥压强变化的主要反应的化学方程式:________。
(7)步骤iii结束后瓶内压强比注入NaOH溶液前小,其原因是__________。
(8)请结合图3信息,说明NaOH与CO2发生了反应。_________。