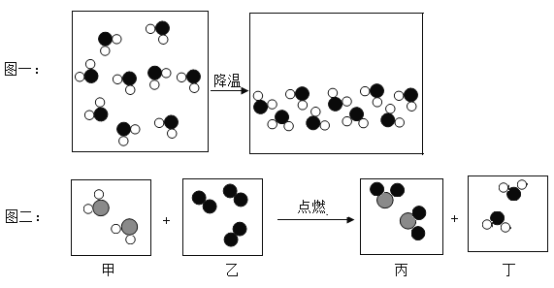
题目内容
【题目】实验室用氯酸钾和二氧化锰的混合物制取氧气,某次实验中有关固体物质的质量变化如下:
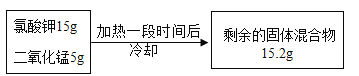
求:(1)生成氧气的质量是_____g。
(2)剩余的固体混合物中含有哪些物质?质量分别是多少? _____(计算结果保留二位小数)
【答案】4.8 剩余固体中含有氯酸钾、氯化钾和二氧化锰,质量分别为2.75g、7.45g和5g。
【解析】
(1)根据质量守恒定律,生成氧气的质量是:15g+5g-15.2g=4.8g。
(2)解:设参加反应的氯酸钾质量为x,反应生成的氯化钾质量为y。
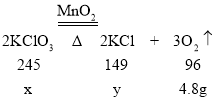
![]() 解得x=12.25g
解得x=12.25g
![]() 解得y=7.45g
解得y=7.45g
根据计算结果可以得出,氯酸钾没有全部反应,剩余固体中氯酸钾的质量为:15g-12.25g=2.75g
答:(1)反应中生成氧气的质量是4.8g;(2)剩余的固体混合物中含有氯酸钾、氯化钾和二氧化锰,质量分别是2.75g、7.45g和5g。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
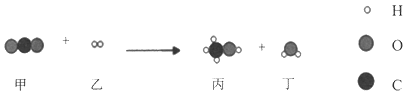
期末集结号系列答案【题目】某物质R完全燃烧,化学方程式为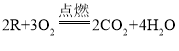 ,下列说法错误的是
,下列说法错误的是
A.R由碳、氢、氧元素组成
B.一个R分子中含有2个碳原子
C.物质R中氢元素的质量和水中氢元素的质量相等
D.生成的二氧化碳和水的分子个数比为1:2
【题目】某同学为了测定不纯的锌片中锌的含量,取不同质量的锌片依次放入盛有稀硫酸的烧杯中,反应完全后称出质量(杂质不参加反应,也不溶于水)。实验结果记录如下:
次数 | 1 | 2 | 3 | 4 | 5 | 6 |
加入锌的质量(g) | 20 | 40 | 60 | 80 | 100 | 120 |
稀硫酸的质量(g) | 200 | 200 | 200 | 200 | 200 | 200 |
烧杯中物质的总质量(g) | 219.6 | _____ | 258.8 | 278.4 | _____ | 318.4 |
(1)将第2次和第5次实验后烧杯中剩余物质的总质量填在上表中;
(2)实验中所用锌片中锌的质量分数为_____;
(3)该实验所使用的稀硫酸的溶质质量分数为_____。(计算结果精确到0.1%)