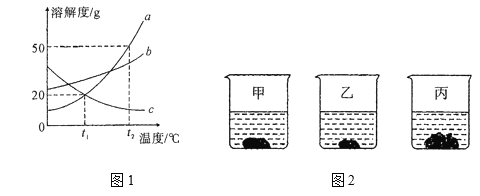
题目内容
【题目】某同学们观察、比较铝箔和铁丝。
(1)金属能加工成“箔”或“丝”,体现了金属的_____性。
(2)铝箔光亮如新,体现了其具有抗腐蚀性,原因是_____,而一些铁丝表面锈迹斑斑,用盐酸可以将其除去,反应的化学方程式为_____。
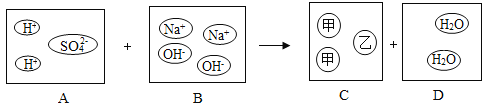
(3)下图为Mn(锰)和CuSO4溶液反应的示意图,回答下列问题:
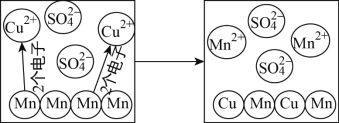
①实际与Mn反应的粒子是_____。
②反应中失去电子的粒子是_____。
③由反应可知金属的活泼性:Mn_____Cu(填“>”或“>”)。
【答案】延展 铝箔表面有一层致密的氧化铝薄膜 ![]()
![]() 锰原子 >
锰原子 >
【解析】
(1)金属能加工成“箔”或“丝”,是利用了金属具有良好的延展性;
(2)铝在空气中能与氧气反应,使铝箔表面有一层致密的氧化铝薄膜,铁锈的主要成分是氧化铁,氧化铁与盐酸反应生成氯化铁和水,化学方程式为:![]() ;
;
(3)①由微粒的变化可知,实际与![]() 反应的粒子是:
反应的粒子是:![]() ;
;
②由于![]() 变成了
变成了![]() ,所以反应中失去电子的粒子是:锰原子;
,所以反应中失去电子的粒子是:锰原子;
③由反应可知,![]() 能将
能将![]() 从其盐溶液中置换出来,金属的活泼性:
从其盐溶液中置换出来,金属的活泼性:![]() >
>![]() 。
。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】硝酸钾的部分溶解度数据见下表。
温度(℃) | 10 | 20 | 40 | 60 |
溶解度(g/100g 水) | 20.9 | 31.6 | 63.9 | 110 |
①20℃时,称取 10.0 克硝酸钾固体加入到 40 克水中,用_____(写出仪器名称)搅拌,充分溶解后得到_____(选填“饱和”或“不饱和”)溶液。
②将上述溶液升温至 60℃,所得溶液的溶质质量分数为_____。
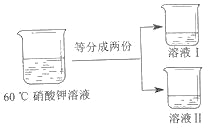
③将 60℃的硝酸钾溶液进行如图所示操作。
将溶液 I 降温,开始析出硝酸钾晶体的温度介于_____℃(选填编号之间。
A. 40-60 B. 20-40 C. 10-20 D. 低于 10
为得到 60℃时硝酸钾饱和溶液,将溶液 II 恒温蒸发 15 克水,请分析该操作能否达到实验目的并说明理由_____。