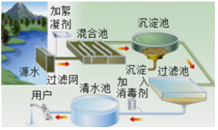
题目内容
【题目】硝酸钾的部分溶解度数据见下表。
温度(℃) | 10 | 20 | 40 | 60 |
溶解度(g/100g 水) | 20.9 | 31.6 | 63.9 | 110 |
①20℃时,称取 10.0 克硝酸钾固体加入到 40 克水中,用_____(写出仪器名称)搅拌,充分溶解后得到_____(选填“饱和”或“不饱和”)溶液。
②将上述溶液升温至 60℃,所得溶液的溶质质量分数为_____。
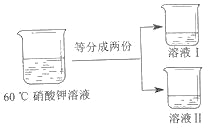
③将 60℃的硝酸钾溶液进行如图所示操作。
将溶液 I 降温,开始析出硝酸钾晶体的温度介于_____℃(选填编号之间。
A. 40-60 B. 20-40 C. 10-20 D. 低于 10
为得到 60℃时硝酸钾饱和溶液,将溶液 II 恒温蒸发 15 克水,请分析该操作能否达到实验目的并说明理由_____。
【答案】玻璃棒 不饱和 20% C 不能溶液 II 恒温蒸发 15 克后溶剂质量为 5g,此时最多可溶解 5.5g硝酸钾,此时溶液中溶质质量为 5g
【解析】
根据固体的溶解度表可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
①20℃时,硝酸钾的溶解度是31.6g,400g水中需要溶解度的硝酸钾为:31.6g×4=126.4g,所以称取100克硝酸钾固体加入到400克水中,用玻璃棒搅拌,充分溶解后得到不饱和溶液;
②将上述溶液升温至60℃,溶质和溶剂质量不变,所以所得溶液的溶质质量分数为:![]()
③20℃,硝酸钾的溶解度是20.9g,400g水中需要溶解度的硝酸钾为:20.9g×4=83.6g,所以将溶液I降温,开始析出硝酸钾晶体的温度介于10-20℃(选填编号)之间,故选:C;
为得到60℃时硝酸钾饱和溶液,将溶液Ⅱ恒温蒸发15克水,该操作不能达到实验目的,理由是:溶液II恒温蒸发15g后溶剂质量为185g,此时最多可溶解203.5g的硝酸钾,而此时溶液中的溶质质量为50g。

【题目】为测定锌铜合金中锌的含量,取该合金放入如右图盛有稀硫酸的锥形瓶中 。多次实验后,取平均值所得数据如下表:
反应前 | 充分反应后装置及反应剩余物质质量 | |
装置和足量的稀硫酸质量 | 锌铜合金质量 | |
342.10g | 16.00g | 357.70g |

若不考虑干燥剂吸收空气中的水蒸气,计算:
(1)根据质量守恒定律求生成氢气的质量 。
(2)该合金中锌的质量分数。