题目内容
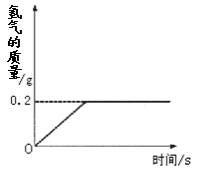
(10分)氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源。某化学兴趣小组取一定质量的氢化锂与99.4克水反应,产生气体的质量与反应时间的关系如图所示,请回答下列问题:
⑴氢化锂与水反应的化学方程式为:
LiH+H2O= +H2↑ 。
+H2↑ 。
则X的化学式为 ;
⑵.氢化锂中Li、H元素质量比为 ;
(3)反应过程中生成氢气的质量为_______g;
(4)取用氢化锂的质量为多少?

⑴氢化锂与水反应的化学方程式为:
LiH+H2O=
 +H2↑ 。
+H2↑ 。则X的化学式为 ;
⑵.氢化锂中Li、H元素质量比为 ;
(3)反应过程中生成氢气的质量为_______g;
(4)取用氢化锂的质量为多少?
(10分)⑴LiOH(1分)⑵ 7:1(2分)
⑶0.2(2分)(4)设LiH的质量为x。……(1分)
LiH+H2O=LiOH+H2↑
8 2
x 0.2g……(2分)
 =
=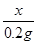 ……(1分)
……(1分)
解之得:x=0.8g……(1分)
答: 取用LiH的质量为0.8g。(解和答全对给1分,若有错误给0分。)
⑶0.2(2分)(4)设LiH的质量为x。……(1分)
LiH+H2O=LiOH+H2↑
8 2
x 0.2g……(2分)
 =
=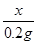 ……(1分)
……(1分)解之得:x=0.8g……(1分)
答: 取用LiH的质量为0.8g。(解和答全对给1分,若有错误给0分。)
试题分析:1、根据质量守恒定律可知,反应LiH+H2O=
 +H2↑中 的X为LiOH;
+H2↑中 的X为LiOH;2、氢化锂中Li、H元素质量比就是Li与H相对原子质量总和的比。故氢化锂中Li、H元素质量比为:Li:H=7:1;
3、由题中曲线图可知,反应过程中生成氢气的质量为0.2g;
4、根据氢气的质量,依据化学方程式可计算出取用LiH的质量。
解:设LiH的质量为x。……(1分)
LiH+H2O=LiOH+H2↑
8 2
x 0.2g……(2分)
 =
=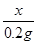 ……(1分)
……(1分)解之得:x=0.8g……(1分)
答: 取用LiH的质量为0.8g。
点评:本题通过化学反应的曲线图来提供计算所需的数据,同学们要先读懂图;元素质量比就是化合物中各元素相对原子质量总和的比;根据化学方程式计算要注意解题的步骤。

练习册系列答案
相关题目

 2HCl)
2HCl)