题目内容
(3分)甲、乙、丙、丁4位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0 g样品溶于一定量的水中得到25.0g溶液,再分别加入不同质量、溶质质量分数为10%的氢氧化钠溶液,反应后得到沉淀及有关实验数据如下表:
反应的化学方程式为:MgCl2+2NaOH→Mg(OH)2↓+2NaCl,试回答下列问题:
(1)恰好完全反应的是_______同学的实验。
(2)计算样品中所含氯化镁的质量分数(写出计算过程,结果精确到0.1%,下同)。
(3)计算丙同学实验后所得溶液中的氯化钠的质量分数。
| 4位同学的实验 | 甲 | 乙 | 丙 | 丁 |
| 加入氢氧化钠溶液质量 (g) | 29.0 | 34.5 | 40.0 | 45.0 |
| 反应得到沉淀的质量 (g) | 2.1 | 2.5 | 2.9 | 2.9 |
(1)恰好完全反应的是_______同学的实验。
(2)计算样品中所含氯化镁的质量分数(写出计算过程,结果精确到0.1%,下同)。
(3)计算丙同学实验后所得溶液中的氯化钠的质量分数。
(1)丙 (2)95% (3)9.8%
试题分析:(1)根据甲、乙、丙三位同学的实验数据分析可知,随着氢氧化钠溶液质量的增加,生成沉淀的质量不断增加,且每增加5.5g氢氧化钠溶液,就有0.4g沉淀增加,故可知这三位同学所加的氢氧化钠已完全反应;再根据丙、丁两同学的实验数据分析可知,虽继续增加氢氧化钠溶液的质量,但沉淀质量不再改变,说明这两个实验中的氯化镁已反应完,则丙同学所做的实验中氯化镁和氢氧化钠恰好完全反应。
(2)根据氢氧化钠的质量求出氯化镁的质量,再根据
 ×100%求出样品中氯化镁的质量分数。
×100%求出样品中氯化镁的质量分数。设样品中所含氯化镁的质量为x,生成氯化钠的质量为y,生成氢氧化镁的质量为z
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 80 58 117
x 40g×10% z y
95:x="80:" 40g×10%
80: 40g×10%="117:y"
80: 40g×10%="58:z"
解得x=4.75g,y=5.85g,z=2.9g
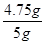 ×100%="95%"
×100%="95%" 答:样品中氯化镁的质量分数为95%。
(3)所得溶液中氯化钠的质量分数=
 ×100%,所得溶液中氯化钠的质量包括样品中氯化钠的质量(样品的质量-氯化镁的质量)和反应生成的氯化钠的质量(根据氢氧化钠的质量求出),所得溶液的质量=所加的所有物质的总质量-沉淀的质量。
×100%,所得溶液中氯化钠的质量包括样品中氯化钠的质量(样品的质量-氯化镁的质量)和反应生成的氯化钠的质量(根据氢氧化钠的质量求出),所得溶液的质量=所加的所有物质的总质量-沉淀的质量。所得溶液中氯化钠的质量分数=
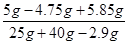 ×100%=9.8%
×100%=9.8% 答:所得溶液中氯化钠的质量分数为9.8%。
点评:此题是关于化学方程式及溶质质量分数的计算题,主要是利用图表及反应方程式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力;解题的关键是要明确所求溶液的溶质是什么,有几部分组成;然后根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,注意解题要规范。

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
 ”分别表示氢和氧两种元素的原子。(已知氢、氧两种原子的相对原子质量分别为:H-1 O-16)
”分别表示氢和氧两种元素的原子。(已知氢、氧两种原子的相对原子质量分别为:H-1 O-16)
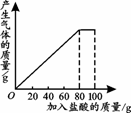

 ,若用22克二氧化碳作为原料,则理论上能转化得到乙烯多少克?
,若用22克二氧化碳作为原料,则理论上能转化得到乙烯多少克?
 +H2↑ 。
+H2↑ 。