题目内容
【题目】铝及化合物有极其重要的用途。
(一)铝的广泛应用
(1)铝是很活泼的金属,但用铝制作的炊具却耐腐蚀,其原因是_________。使用铝制炊具会使人体摄入过量的“铝”,导致记忆力减退等许多不良症状。这里的“铝”是指________。
A. 单质 B. 元素 C. 原子 D. 分子
(2)氢能源是最理想的能源,科学家研发出一种以“铝镓合金”和水为原料制取氢气的新工艺。“铝镓合金”它属于________(选填序号)。
A.金属材料 B.无机非金属材料 C.合成材料 D.复合材料
(3)实验室可用铝片与稀盐酸反应制备氢气,写出该反应的化学方程式:_________。
(二)硫酸铝铵晶体制取的探究
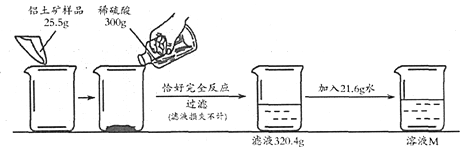
硫酸铝铵是一种用途广泛的含铝化合物。以某铝土矿(主要成分Al2O3,含少量SiO2、Fe2O3杂质)为原料制硫酸铝铵晶体【(NH4)aAlb(SO4)c·xH2O】的流程如下:
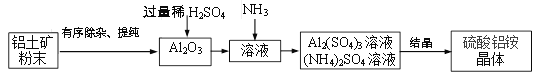
(4)铝土矿粉碎的目的是__________。
(5)有关上述流程的说法正确的是_________。
a.“有序除杂、提纯”中有先加过量稀盐酸再过滤,该做法的目的是除去SiO2
b. 稀硫酸过量的目的只是保证Al2O3溶解完全
(三)硫酸铝铵晶体分解的定性探究
硫酸铝铵热分解可得到纳米氧化铝。兴趣小组在科研人员指导下,设计实验探究硫酸铝铵晶体受热分解的产物。
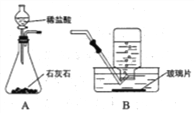
(6)甲组同学设计了如图1所示实验装置:
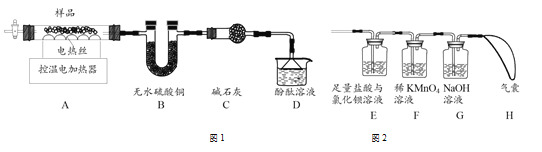
①实验中,装置B中观察到的现象是___________;
②装置D中观察到酚酞溶液变红色,由此可知分解的产物中有_________(写化学式)。
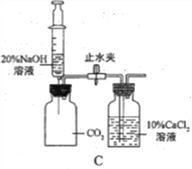
(7)乙组同学认为硫酸铝铵晶体受热分解的产物中还有SO2、SO3和N2。为进行验证,用甲组实验中的装置A和上图2所示装置连接进行实验。观察到装置E中_______,证明了有SO3生成;而F装置中__________、H最终没有胀大,表明没有SO2和N2生成。
(四)硫酸铝铵晶体成分的定量探究
(8)为确定硫酸铝铵晶体的组成,进行如下实验:
【实验1】称取45.3g样品与足量氯化钡溶液充分反应,生成白色沉淀46.6g。
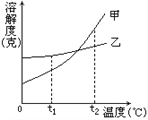
【实验2】称取45.3g样品在空气中持续加热,测定剩余固体质量随温度变化的曲线如图所示。
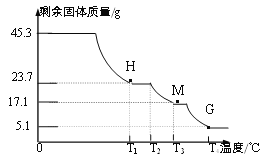
①固体H是T1℃刚好完全失去结晶水的产物,
则结晶水的个数x=________;
②T3℃时固体M的化学式______。
③请写出T2℃→T4℃段发生反应的总化学方程式:__________。
【答案】 表面形成致密而结实的氧化膜 B A 2Al +6HCl=2AlCl3 + 3H2↑ 增大反应物的接触面积,充分反应或加快反应 a 变蓝色 NH3 产生白色沉淀 不褪色或无现象 12 Al2(SO4)3 2 NH4Al(SO4)2 ![]() Al2O3 + 4SO3 ↑ + H2O ↑ + 2NH3 ↑
Al2O3 + 4SO3 ↑ + H2O ↑ + 2NH3 ↑
【解析】(一)铝的广泛应用(1)铝是很活泼的金属,但用铝制作的炊具却耐腐蚀,其原因是铝在常温下和空气中的氧气反应,表面形成致密而结实的氧化膜,阻止铝的进一步锈蚀;使用铝制炊具会使人体摄入过量的“铝”,导致记忆力减退等许多不良症状。这里的“铝”是指铝元素; (2)金属和合金都属于金属材料。“铝镓合金”它属于金属材料;(3)铝片与稀盐酸反应生成氢气和氯化铝,该反应的化学方程式:2Al +6HCl=2AlCl3 + 3H2↑;(二)(4)铝土矿粉碎的目的是增大反应物的接触面积,使反应更充分、更迅速;(5)氧化铁和氧化铝都能与硫酸反应生成可溶性盐,二氧化硅与酸不反应, “有序除杂、提纯”中有先加过量稀盐酸再过滤,该做法的目的是除去SiO2,正确;稀硫酸过量的目的是保证Al2O3和氧化铁都溶解完全,错误;(三) (6) ①实验中,装置B中观察到的现象是固体变成蓝色,因为硫酸铜和水反应生成硫酸铜晶体;②装置D中观察到酚酞溶液变红色,由此可知分解的产物中有氨气(NH3),因氨气溶于水生成氨水,是碱,溶液呈碱性;(7)观察到装置E中白色沉淀,证明了有SO3生成,因为三氧化硫和水生成硫酸,硫酸和氯化钡生成不溶于酸的硫酸钡白色沉淀;而F装置中溶液不变色,说明没有二氧化硫,因二氧化硫能使高锰酸钾溶液褪色,H最终没有胀大,表明没有N2生成;(四)①固体H是T1℃刚好完全失去结晶水的产物,故结晶水的质量为45.3g-23.7g=21.6g,则结晶水的个数x=216÷18=12;②T1℃~T3℃时,硫酸铝铵分解生成硫酸铝,固体M为硫酸铝,化学式:Al2(SO4)3;③T2℃→T4℃段发生反应的总化学方程式:2 NH4Al(SO4)2 ![]() Al2O3 + 4SO3 ↑ + H2O ↑ + 2NH3 ↑。
Al2O3 + 4SO3 ↑ + H2O ↑ + 2NH3 ↑。