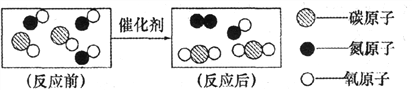
题目内容
【题目】某兴趣小组进行CO2气体的制取、并验证CO2能与NaOH发生化学反应的实验。
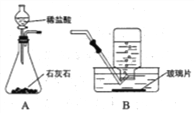
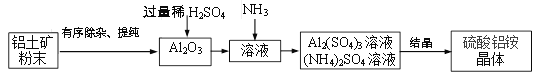
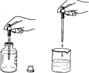
(1)用上图装置制取CO2气体。
①写出反应的化学方程式: ____________。
②A装置用分液漏斗加液,与用长颈漏斗加液比较,其优点是_______________。
③从B装置中取出收集满CO2气体集气瓶的操作是_____________。
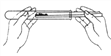
(2)通过C装置验证CO2能与NaOH发生化学反应。推注射器活塞向充满CO2的集气瓶中注入过量溶质质量分数为20%的NaOH溶液,振荡集气瓶后打开止水夹。
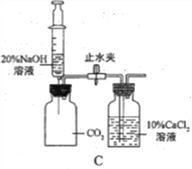
①打开止水夹后观察到的现象是______。
②反应后将集气瓶中混合物过滤,所得溶液中除CaCl2外,还存在的溶质有_____。
【答案】 CaCO3+2HCl==CaCl2+H2O+CO2↑ 能够控制反应速率 将导管移出水面,用毛玻璃片盖上瓶口,将集气瓶移出水面正立放置 氯化钙溶液流入左边的集气瓶中,并且溶液变浑浊 氢氧化钠、氯化钠、氢氧化钙
【解析】本题考查了实验室二氧化碳制取和验证CO2能与NaOH溶液反应的实验。根据二氧化碳制取的操作注意点和碱、盐的化学性质进行分析。
(1)①碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,化学方程式是:CaCO3+2HCl==CaCl2+H2O+CO2↑;
②分液漏斗能够控制液体药品的流量,从而可以控制反应速率。用分液漏斗代替长颈漏斗具有的优点是能够控制反应速率;
③从B装置中取出收集满CO2气体集气瓶的操作是将导管移出水面,用毛玻璃片盖上瓶口,将集气瓶移出水面正立放置;
(2)①推注射器活塞向充满CO2的集气瓶中注入过量 20%的NaOH溶液,二氧化碳和氢氧化钠反应生成碳酸钠和水,导致左边的集气瓶中的气压减小,打开止水夹后,氯化钙溶液流入左边的集气瓶中,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,因此观察到的现象是:氯化钙溶液流入左边的集气瓶中,并且溶液变浑浊;
②反应后将集气瓶中混合物过滤,所得溶液中除CaCl2外,还存在的溶质有过量的氢氧化钠、反应生成的氯化钠、氢氧化钙等。

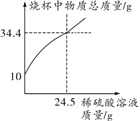
【题目】已知M、N分别是稀硫酸、氢氧化钠溶液中的一种。某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如下图所示:
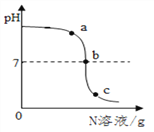
(1)M是______________。
(2)反应过程中,老师分别取图中a、b、c三处所对应的溶液,打乱顺序后,请同学们用一定的方法将三种溶液加以鉴别(不用测定溶液pH的方法)。
小明和小红分别取其中一种溶液进行实验:小明向所取溶液中加入___________溶液,观察到有蓝色沉淀生成。
结论:是a处溶液。
小红向少量另一种溶液中滴加酚酞溶液,观察到____________。
结论:是b处或c处溶液。
为进一步确定该溶液成分,小红又设计并完成如下实验:
实验步骤 | 实验现象 | 结论及化学方程式 |
取少量氧化铁,加入足量该溶液 | 固体完全溶解,且_____________ | 相关的化学方程式为_____________。 为c处溶液,并推知c处溶液中含有的离子有_____________(填写离子符号) |
结论:剩余一种为b处溶液。