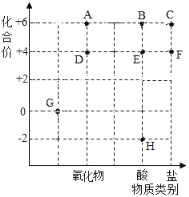
题目内容
【题目】现用质量分数为98%的浓硫酸(密度是1.84g/cm3)配制560g质量分数为14%的稀硫酸时,下列有关叙述正确的是( )
A. 配制稀硫酸时,用到的玻璃仪器只有量筒和烧杯
B. 配制稀硫酸时,一定不能用天平称量所需浓硫酸的质量
C. 将80g98%的浓硫酸沿1000mL烧杯内壁缓缓倒入480mL水中,并不断搅拌
D. 将480mL水倾倒入盛有80mL98%浓硫酸的500mL量筒中
【答案】C
【解析】
A、由浓溶液稀释配制溶液,一般采用用量筒量取浓溶液与水,在烧杯中混合完成,一般不需固体的称量,无需托盘天平,但除量筒与烧杯外,稀释过程还需用玻璃棒搅拌,故A错误;
B、由浓溶液配制稀溶液,经计算得出浓溶液与水的质量,一般将二者的质量换算成体积,再用量筒量取二者体积即可,一般不用托盘天平(因操作比较麻烦),但并非不可以,用托盘天平仍然可以达到实验目的,故B错误;
C、稀硫酸中溶质质量:560g×14%=78.4g,所需浓硫酸质量:78.4g÷98%=80g,所需水的质量:560g﹣80g=480g,所需水的体积:![]() =480cm3=480mL,与选项中各数据均相同,故C正确;
=480cm3=480mL,与选项中各数据均相同,故C正确;
D、依据C项中结果,所需浓硫酸的体积为:![]() =43.48cm3=43.48mL,稀释浓硫酸要将浓硫酸缓缓倒入水中,防止液体飞溅伤人,量筒不能用作溶解容器,应在烧杯中稀释,D错。
=43.48cm3=43.48mL,稀释浓硫酸要将浓硫酸缓缓倒入水中,防止液体飞溅伤人,量筒不能用作溶解容器,应在烧杯中稀释,D错。
故选:C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目