题目内容
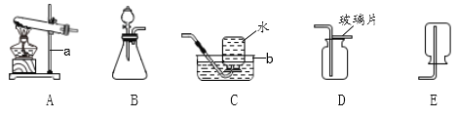
【题目】根据如图所示的实验装置图回答:
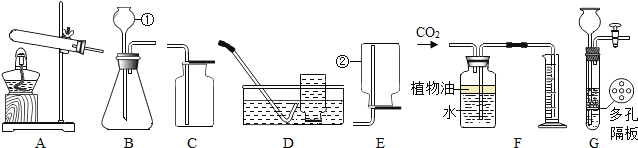
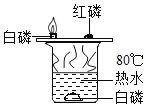
(1)实验室用氯酸钾和二氧化锰混合加热制取氧气,应选择的发生装置是_____(填序号),该反应的化学方程式为_____。
(2)排水法收集完氧气后,应先_____再_____,目的是_____。
(3)实验室用石灰石和稀盐酸反应制取CO2,应选用的收集装置是_____(填序号),该反应的化学方程式为_____,仪器①的下端必须伸入反应物液面以下形成“液封”,其原因是_____。
(4)装置F可用来测量生成CO2的体积,其中在水面上放一层植物油的目的是_____;植物油上面的空气对测量生成CO2的体积_____(填“有”或“无”)影响。
(5)B装置中编号①的仪器名称是_____。G装置和B装置都可用作实验室用锌粒和稀硫酸反应制取氢气的发生装置,G装置与B装置比较,G装置除了节约药品优点外,还有操作上的优点是_____。
⑥实验室常用氯化铵固体与碱石灰固体共热来制取氨气(化学式:NH3)。常温下NH3是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水。制取并收集NH3,应该从图中选择的发生装置是_____(填序号),收集装置是_____(填序号)。
【答案】A 2KClO3![]() 2KCl+3O2↑ 把导管移出水面 熄灭酒精灯 防止冷水倒吸、炸裂试管 C CaCO3+2HCl=CaCl2+CO2↑+H2O 防止二氧化碳从长颈漏斗处逸出 防止二氧化碳溶于水 无 长颈漏斗 能使反应随时进行或停止 A E
2KCl+3O2↑ 把导管移出水面 熄灭酒精灯 防止冷水倒吸、炸裂试管 C CaCO3+2HCl=CaCl2+CO2↑+H2O 防止二氧化碳从长颈漏斗处逸出 防止二氧化碳溶于水 无 长颈漏斗 能使反应随时进行或停止 A E
【解析】
(1)实验室用氯酸钾和二氧化锰混合加热制取氧气属于固体加热型,选择装置A来制取,氯酸钾在二氧化锰的催化作用下分解为氯化钾和氧气;反应的化学方程式为:
2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(2)排水法收集完氧气后,应先把导管移出水面,再熄灭酒精灯,目的是防止水倒流入试管,从而防止炸裂试管;故填:把导管移出水面;熄灭酒精灯;防止冷水倒吸、炸裂试管;
(3)二氧化碳能够溶于水,不能用排水法收集,密度比空气大,可以用向上排空气法收集,即用C装置收集;该反应的化学方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O;仪器①的下端必须伸入反应物液面以下形成“液封”,其原因是防止二氧化碳从长颈漏斗处逸出;
(4)如图F所示装置可用来测量生成CO2的体积,其中在水面上放一层植物油的目的是防止二氧化碳溶于水。植物油上面的空气对测量生成CO2的体积没有影响;
(5)仪器①是长颈漏斗,G装置除了节约药品优点外,还有操作上的优点是能使反应随时进行或停止,原理是:关闭开关时,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止,打开开关时,气体导出,试管中的气体减少,压强减小,液体和固体混合,反应进行;
(6)实验室用氯化铵固体与碱石灰固体共热来制取氧气时,应该用A装置作为发生装置;氨气极易溶于水,不能用排水法收集,密度比空气小,可以用向下排空气法收集,即用E装置收集。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用2.0g石灰石样品,把25.0g稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如下:
实验次数 | 1 | 2 | 3 | 4 | 5 |
稀盐酸的累计加入量 | 5.0g | 10.0g | 15.0g | 20.0g | 25.0g |
剩余固体的质量 | 1.5g | m | 0.5g | 0.3g | 0.3g |
计算:
(1)m=______g。
(2)石灰石中碳酸钙的质量分数为______。
(3)2.0g石灰石样品与足量稀盐酸反应,产生二氧化碳的质量是多少?_____(写出解题过程)