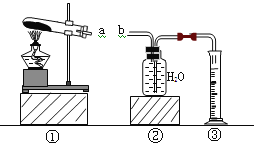
题目内容
【题目】某化学课堂上同学们正在进行酸、碱、盐知识的探究,你参与其中并认真填写空格.
【学生实验】将二氧化碳分别通入澄清石灰水和氢氧化钠溶液中,观察到前者变浑浊,后者没有明显现象,
【提出问题】二氧化碳通入氢氧化钠溶液中无明显现象,两者是否发生了化学反应?
【猜想假设】猜想①:两者发生了化学反应;猜想②:两者没有发生化学反应
【实验探究】
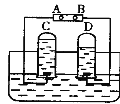
(1)李华同学设计了如图所示的A、B两个实验.
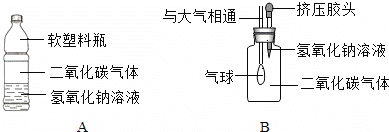
实验现象:A中 ,B中 。
(2)小红认为李华的实验是可行的,其共同原理是二氧化碳和氢氧化钠溶液反应,会使容器内压强降低.小明同学却对此提出质疑,他认为李华的实验不严谨,其理由是 ,要得到科学严谨的结论,如果利用B装置,应补做的实验是 ,如果观察到 ,则证明猜想①成立。
小明同学受酸碱中和反应探究实验的启发,认为可以借助酚酞试液来证明,小红同学认为不可行,你赞同 的观点,理由是 。
海宁同学设计的方案是通过检验生成物来验证猜想,请帮他填写实验报告。
实验步骤 | 实验现象 | 实验结论 |
向B实验后的溶液中加入 | 猜想①成立,相关化学方程式 |
【实验结论】二氧化碳和氢氧化钠溶液发生了反应.。
【反思拓展】
(1)氢氧化钠溶液必须密封保存,原因是 (用化学方程式表示)。
(2)通过同学们的探究,我们发现,对于没有明显现象的化学反应,可以从两个不同的角度证明: ; 。
【答案】(1)A中软塑料瓶変瘪,B中气球膨胀变大(合理说法均可)
(2)二氧化碳能与水反应,也能使容器内压强降低 将氢氧化钠溶液换成等体积的水,与加入氢氧化钠溶液的实验现象进行对比 气球膨胀程度变小
(3)小红 生成的碳酸钠溶液也显碱性,也会使酚酞变红
(4)
实验步骤 | 实验现象 | 实验结论 |
向B实验后的溶液中加入稀盐酸(或氢氧化钡溶液等) | 有气泡产生(或有白色沉淀生成等) | 猜想①成立,相关化学方程式 Na2CO3+2HCl=2NaCl+H2O+CO2 ↑ (或 Na2CO3+Ba(OH)2=BaCO3↓ +2NaOH ) |
【反思拓展】
(1)2NaOH+CO2=Na2CO3+H2O
(2)可以通过检验反应物减少证明反应发生;可以通过检验生成物证明反应发生
实验方法 | 可能观察到的现象 | 结论 |
取两只试管,分别加入等质量的的Mg(OH)2和等质量的热水,振荡,各滴入数滴无色酚酞,一只保持温度不变,另一只自然冷却 | 保持温度不变的红色不消失,自然冷却的红色消失 |
【解析】
试题分析:(1)由于二氧化碳会与氢氧化钠溶液反应生成碳酸钠和水,导致瓶内的压强变小,故A中软塑料瓶変瘪;B中瓶内的压强变小,大气压强把气体压入气球中,故B中气球膨胀变大;
(2)由于二氧化碳能与水反应,也能使容器内压强降低,故不能确定是二氧化碳与氢氧化钠反应产生的现象;可做对比实验来进行验证,如利用B装置,将氢氧化钠溶液换成等体积的水,与加入氢氧化钠溶液的实验现象进行对比,根据气球膨胀程度来判断,若气球更小,则证明是二氧化碳与氢氧化钠发生了化学反应;
(3)氢氧化钠与二氧化碳反应生成的碳酸钠溶液也是呈碱性的,故不能用酚酞试液来判断他们是否发生了化学反应;
(4)要检验是否生成了碳酸钠,可加入稀盐酸,若产生了气泡则证明氢氧化钠溶液与二氧化碳发生了反应;
(5)氢氧化钠易与空气中的二氧化碳反应,故要密封保存;对于没有明显现象的化学反应,可以通过检验反应物减少证明反应发生 ; 可以通过检验生成物证明反应发生。