题目内容
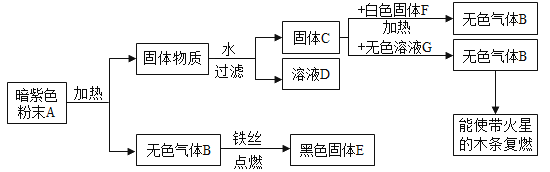
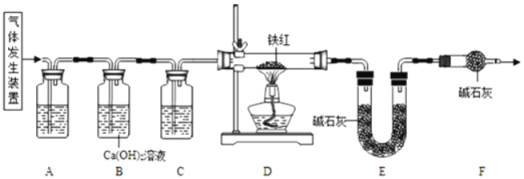
【题目】探究一:工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4.某兴趣小组用草酸晶体制取CO,并进行了如图所示实验。
试回答:
(查阅资料)草酸晶体(H2C2O42H2O)在浓H2SO4作用下受热分解生成CO2和CO。
(1)实验前应先_____。
(2)进入D中的气体是纯净、干燥的CO,则A中试剂是_____、C中的试剂是_____(填字母)。
a 浓硫酸 b 澄清的石灰水 c 氢氧化钠溶液
(3)F装置的作用是_____,若缺少该装置,则所测氧元素的质量分数将_____(填“偏大”“偏小”或“不变”)
(4)某同学认为图示装置有不足之处,改进的方法是_____。
(5)写出装置D中氧化铁与CO反应的化学方程式:_____。
探究二:求某草酸样品中草酸晶体(H2C2O42H2O)的质量分数。
称取8.75g草酸晶体样品配制50.00g溶液,取10.00g溶液加适量的稀硫酸,然后滴加25.00g3.16%KMnO4溶液,恰好反应完全。(已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O)
则KMnO4溶液显_____色,25.00g3.16%KMnO4溶液中KMnO4的质量_____g.请计算样品中草酸晶体(H2C2O42H2O)的质量分数_____。[写出计算过程,M2(H2C2O4)=90,M2(H2C2O42H2O)=126,M2(KMnO4)=158]。
【答案】检查装置气密性 c a 防止空气中的水蒸气和二氧化碳进入E装置 偏大 在F装置后面系一个气球,收集尾气,或点燃尾气等 Fe2O3+3CO![]() 2Fe+3CO2 紫色 7.875g 90%
2Fe+3CO2 紫色 7.875g 90%
【解析】
探究一:
(1)实验前应先检查装置气密性。故填:检查装置气密性。
(2)进入D中的气体是纯净、干燥的CO,则A中试剂是氢氧化钠溶液,用来吸收二氧化碳、C中的试剂是浓硫酸,用来吸收水蒸气。故填:c;a。
(3)F装置的作用是防止空气中的水蒸气和二氧化碳进入E装置;若缺少该装置,导致E装置测定的二氧化碳质量偏大,从而导致计算的氧元素质量偏大,则所测氧元素的质量分数将偏大。故填:防止空气中的水蒸气和二氧化碳进入E装置;偏大。
(4)图示装置有不足之处,即没有处理尾气,改进的方法是:在F装置后面系一个气球,收集尾气,或点燃尾气等。故填:在F装置后面系一个气球,收集尾气,或点燃尾气等。
(5)装置D中高温条件下氧化铁和一氧化碳反应生成铁和二氧化碳,氧化铁与CO反应的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2。故填:Fe2O3+3CO
2Fe+3CO2。故填:Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。
探究二:
KMnO4溶液显紫色;25.00g3.16%KMnO4溶液中KMnO4的质量为:25.00g×3.16%=0.79g;
设H2C2O4质量为x,

![]()
x=1.125g,
则H2C2O42H2O质量为:1.125g÷90/126×5=7.875g,
样品中草酸晶体(H2C2O42H2O)的质量分数为:7.875g/8.75g×100%=90%,
答:样品中草酸晶体(H2C2O42H2O)的质量分数为90%。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案