题目内容
【题目】四十七中学化学活动小组在一次实验中进行了如图1所示实验
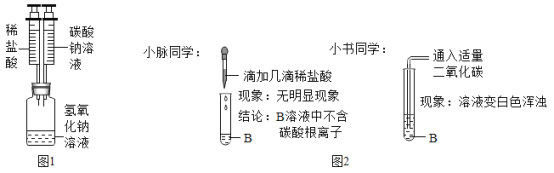
先将稀盐酸滴入图1容器,然后将碳酸钠溶液滴入图1容器,观察到立即产生白色沉淀,则滴入碳酸钠溶液的过程中一定发生反应的化学方程式为_____,小组同学对无色溶液B的成分产生了浓厚的兴趣,进行了进一步的探究活动。小叶同学认为一定含有的离子是_____,一定不含的离子是_____。
(提出猜想)溶液B中还含有什么离子?
(实验探究)如图2
(评价交流)请对小脉同学由实验所得的结论进行评价_____;
(实验结论)结合上述实验最终确定B中还含有_____(填离子符号),从而推出还不含_____(填离子符号)。
(归纳总结)在确定溶液中可能存在的离子是否存在时,当确定某些离子存在后,可利用离子之间_____确定其他离子的存在情况。
【答案】Na2CO3+CaCl2═CaCO3↓+2NaCl 钠离子、氯离子 氢离子 不正确,这是因为如果氢氧化钙和稀盐酸反应后过量时,碳酸钠和氢氧化钙反应生成氢氧化钠后碳酸钠过量时,滴加的稀盐酸如果不足以和氢氧化钠反应,则溶液中即使含有碳酸钠,也不产生气泡 Ca2+、OH﹣ CO32﹣ 反应产生明显现象
【解析】
观察到立即产生白色沉淀,说明稀盐酸已经完全反应,则滴入碳酸钠溶液的过程中一定发生的反应是:稀盐酸和氢氧化钙反应生成的氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl;
无色溶液B中一定含有的离子是钠离子、氯离子,一定不含的离子是氢离子。
故填:Na2CO3+CaCl2═CaCO3↓+2NaCl;钠离子、氯离子;氢离子。
[评价交流]
小脉同学的实验结论不正确,这是因为如果氢氧化钙和稀盐酸反应后过量时,碳酸钠和氢氧化钙反应生成氢氧化钠后碳酸钠过量时,滴加的稀盐酸如果不足以和氢氧化钠反应,则溶液中即使含有碳酸钠,也不产生气泡。
故填:不正确,这是因为如果氢氧化钙和稀盐酸反应后过量时,碳酸钠和氢氧化钙反应生成氢氧化钠后碳酸钠过量时,滴加的稀盐酸如果不足以和氢氧化钠反应,则溶液中即使含有碳酸钠,也不产生气泡。
[实验结论]
通入二氧化碳时溶液变浑浊,说明溶液中含有氢氧化钙,B中含有的离子有钠离子、氯离子、钙离子、氢氧根离子,不含有碳酸根离子。
故填:Ca2+、OH﹣; CO32﹣。
[归纳总结]
在确定溶液中可能存在的离子是否存在时,当确定某些离子存在后,可利用离子之间反应产生明显现象确定其他离子的存在情况。
故填:反应产生明显现象。