题目内容
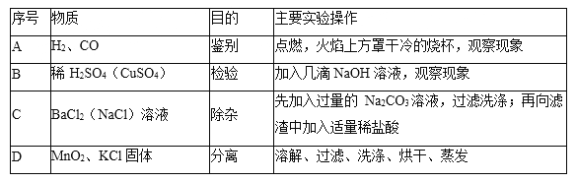
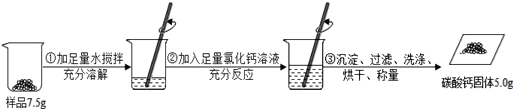
【题目】某碳酸钠样品中混有少量氯化钠,根据如图所示信息完成相关计算。
(反应的化学方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl)
(1)Na2CO3由 种元素组成;
(2)一个Na2CO3分子中Na、C、O的原子个数比为 ;
(3)Na2CO3中氧元素的质量分数是 %(结果精确到0.1%);
(4)计算该样品中碳酸钠的质量分数。(写出计算过程,结果精确到0.1%)
【答案】(1)3;(2)2:1:3(或54:48);(3)45.3;(4)70.7%
【解析】(1)Na2CO3由钠元素、碳元素和氧元素三种元素组成的;
(2)根据化学式可知,一个Na2CO3分子中Na、C、O的原子个数比为 2:1:3;
(3)Na2CO3中氧元素的质量分数![]() ≈45.3%%;
≈45.3%%;
(4)解:样品中Na2CO3的质量为x
CaCl2+Na2CO3=CaCO3↓+2NaCl
106 100
x 5g
![]()
x=5.3g
该样品中碳酸钠的质量分数为![]() ≈70.7%
≈70.7%
答:样品中Na2CO3的质量分数为70.7%。

【题目】除去下列物质中混有的少量杂质(括号内为杂质),所用方法不正确的是
物质 | 除杂方法 | |
A | N2( O2 ) | 将气体通过灼热的铜网 |
B | CaCO3(NaCl) | 溶解,过滤 |
C | CO(CO2) | 将气体通过氢氧化钠溶液 |
D | Na2CO3溶液(NaOH) | 滴加稀盐酸至恰好完全反应 |
A. A B. B C. C D. D
【题目】学习了MnO2对过氧化氢分解有催化作用的知识后,某同学想:CuO能否起到类似MnO2的催化剂作用呢?于是进行了以下探究。
【猜想】Ⅰ、CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ、CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ、CuO是反应的催化剂,反应前后_____________________________。
【实验】用天平称量0.2gCuO,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
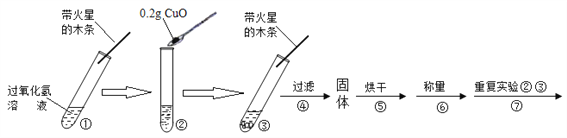
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
________ 带火星的木条复燃。 | ______ | 溶液中有气泡放出,________ | 猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立。 |
(2)步骤①的目的是___________________________________。
(3)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、___________。
(4)过氧化氢能被CuO催化分解的化学方程式为_______________________。
【拓展】要探究步骤⑤做过催化剂的CuO其它化学性质,还应补做的实验是____。(写一种)