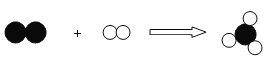题目内容
【题目】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环制氢气是一种高效、无污染的制氢方法。其反应过程如图所示:
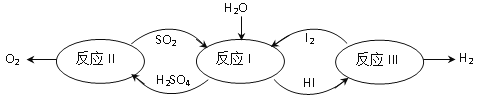
(1)写出反应I的化学方程式_____
(2)反应Ⅲ的基本反应类型为_____
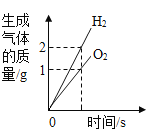
(3)已知反应I、反应Ⅱ、反应Ⅲ均充分反应。假设反应Ⅲ中产生H2的质量为11g,你认为能否通过计算得出反应Ⅱ中产生的O2的质量,若能,请写出O2的质量;若不能,请说明理由_____:
【答案】SO2+2H2O+I2=2HI+H2SO4 分解反应 能、88g
【解析】
(1)二氧化硫、水和碘反应生成硫酸、碘化氢,故反应I的化学方程式为:SO2+2H2O+I2=2HI+H2SO4
(2)反应Ⅲ是碘化氢发生化学反应生成碘和氢气,由一种物质发生化学反应生成两种或多种物质的反应是分解反应。
(3)根据反应过程可知,二氧化硫、硫酸是可循环利用的物质,故该过程中的氧气、氢气都来自于水,水发生分解反应生成氧气、氢气的质量比是8:1,能计算出生成氧气的质量,生成氧气的质量为88g。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
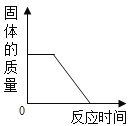
优化作业上海科技文献出版社系列答案【题目】小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中碳酸钙的质量分数进行检测,采用的办法如下:取用8 g这种石灰石样品,把40 g稀盐酸分4次加入,测量过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应)。请计算:
(1)8 g石灰石样品中含有杂质多少克____________?
(2)样品中碳酸钙的质量分数是多少_________________?
(3)下表中m的数值应该为多少____________?
序号 | 加入稀盐酸质量/g | 剩余固体质量/g |
第1次 | 10 | 5.5 |
第2次 | 10 | m |
第3次 | 10 | 1.2 |
第4次 | 10 | 1.2 |
(4)要得到280 kg CaO,需要质量分数为80%的石灰石多少千克_____________?(化学方程式:CaCO3![]() CaO+CO2↑)
CaO+CO2↑)
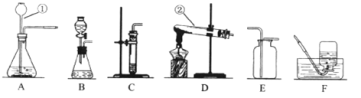
【题目】化学教材“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣.
(提出问题)(1)氧化铁(Fe2O3)能否作过氧化氢溶液分解的催化剂?
(2)氧化铁与二氧化锰催化效果哪个好?
(3)催化剂的质量是否对过氧化氢溶液分解的速率产生影响?
(实验探究)
实验步骤 | 实验现象 |
①分别量取5mL15%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星的木条,观察现象 | A试管中产生大量气泡,带火星木条复燃, B试管中的现象:…… |
②待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管内,如此反复多次实验,观察现象 | 试管中均产生大量气泡,带火星木条均复燃 |
③将实验②中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag | |
④分别量取5mL15%过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象 |
(1)A试管中反应的符号表达式为_________;B试管中的现象________。
(2)实验②、③证明:氧化铁的___________和____在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)实验设计④的目的是_________,若实验![]() 观察到D试管中产生气泡的速率更快,由此你可以得到的结论是____。
观察到D试管中产生气泡的速率更快,由此你可以得到的结论是____。
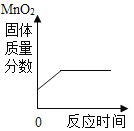
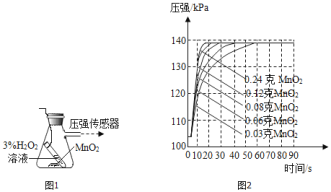
(4)兴趣小组同学设计了如图1实验装置,利用压强传感器测不同质量二氧化锰对双氧水分解快慢的影响。在8mL3%的双氧水中分别加入了0.03g,0.06g,0.08g,0.12g,0.24gMnO2测得容器内压强的变化曲线如图2所示![]() 曲线的斜率表征催化反应的速率
曲线的斜率表征催化反应的速率![]() 请观察如图,回答问题:
请观察如图,回答问题:
![]() Ⅰ
Ⅰ![]() 根据图2可发现:该实验条件下,30s内催化分解8mL浓度为
根据图2可发现:该实验条件下,30s内催化分解8mL浓度为![]() 的双氧水,MnO2的最小用量为_____g。
的双氧水,MnO2的最小用量为_____g。
![]() Ⅱ
Ⅱ![]() 根据图2,下列说法正确的是________。
根据图2,下列说法正确的是________。
a 二氧化锰用量越多,产生氧气越多
b 反应容器的气密性,对实验所测数据的精确度有影响
c 称量的二氧化锰质量的精确度对实验装置中最终的压强大小没有影响
(知识拓展)
若实验中ag氧化铁中a=0.25,则其中氧元素的质量为__________g。若经过精密仪器测得该氧化铁样品中铁元素和氧元素的质量比为21∶8,则该氧化铁样品中混有的另一物质是___________(填“FeO”或“Fe3O4”)