题目内容
【题目】化学教材“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣.
(提出问题)(1)氧化铁(Fe2O3)能否作过氧化氢溶液分解的催化剂?
(2)氧化铁与二氧化锰催化效果哪个好?
(3)催化剂的质量是否对过氧化氢溶液分解的速率产生影响?
(实验探究)
实验步骤 | 实验现象 |
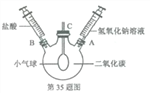
①分别量取5mL15%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星的木条,观察现象 | A试管中产生大量气泡,带火星木条复燃, B试管中的现象:…… |
②待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管内,如此反复多次实验,观察现象 | 试管中均产生大量气泡,带火星木条均复燃 |
③将实验②中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag | |
④分别量取5mL15%过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象 |
(1)A试管中反应的符号表达式为_________;B试管中的现象________。
(2)实验②、③证明:氧化铁的___________和____在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)实验设计④的目的是_________,若实验![]() 观察到D试管中产生气泡的速率更快,由此你可以得到的结论是____。
观察到D试管中产生气泡的速率更快,由此你可以得到的结论是____。
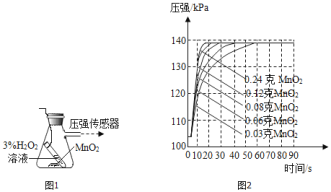
(4)兴趣小组同学设计了如图1实验装置,利用压强传感器测不同质量二氧化锰对双氧水分解快慢的影响。在8mL3%的双氧水中分别加入了0.03g,0.06g,0.08g,0.12g,0.24gMnO2测得容器内压强的变化曲线如图2所示![]() 曲线的斜率表征催化反应的速率
曲线的斜率表征催化反应的速率![]() 请观察如图,回答问题:
请观察如图,回答问题:
![]() Ⅰ
Ⅰ![]() 根据图2可发现:该实验条件下,30s内催化分解8mL浓度为
根据图2可发现:该实验条件下,30s内催化分解8mL浓度为![]() 的双氧水,MnO2的最小用量为_____g。
的双氧水,MnO2的最小用量为_____g。
![]() Ⅱ
Ⅱ![]() 根据图2,下列说法正确的是________。
根据图2,下列说法正确的是________。
a 二氧化锰用量越多,产生氧气越多
b 反应容器的气密性,对实验所测数据的精确度有影响
c 称量的二氧化锰质量的精确度对实验装置中最终的压强大小没有影响
(知识拓展)
若实验中ag氧化铁中a=0.25,则其中氧元素的质量为__________g。若经过精密仪器测得该氧化铁样品中铁元素和氧元素的质量比为21∶8,则该氧化铁样品中混有的另一物质是___________(填“FeO”或“Fe3O4”)
【答案】 有少量气泡产生,但带火星的木条不能复燃 化学性质 质量 证明氧化铁与二氧化锰的催化效果哪个更好 二氧化锰的催化效果比氧化铁好 0.08 bc 0.075 FeO
有少量气泡产生,但带火星的木条不能复燃 化学性质 质量 证明氧化铁与二氧化锰的催化效果哪个更好 二氧化锰的催化效果比氧化铁好 0.08 bc 0.075 FeO
【解析】
(1)A试管中是氧化铁催化过氧化氢制氧气的反应,所以此反应的符号表达式为 ;B试管中由于只有过氧化氢,所以产生的氧气速率较慢,只有少量气泡,氧气量较少,则带火星的木条没有复燃,所以B中的现象是有少量气泡产生,但带火星的木条不能复燃。
;B试管中由于只有过氧化氢,所以产生的氧气速率较慢,只有少量气泡,氧气量较少,则带火星的木条没有复燃,所以B中的现象是有少量气泡产生,但带火星的木条不能复燃。
(2)实验②、③证明:氧化铁的化学性质和质量在反应前后均没有发生变化,可以作过氧化氢分解的催化剂,因为实验②重复做了此实验,氧化铁的催化效果不变,证明其化学性质不变、实验③是再次称量,质量仍为ag,则证明其质量在反应前后没变。
(3)实验设计④的目的是证明氧化铁与二氧化锰的催化效果哪个更好,实验④观察到D试管中产生气泡的速率更快,由此可以得到的结论是:二氧化锰的催化效果比氧化铁好。
(4)![]() Ⅰ
Ⅰ![]() 根据图2可发现:该实验条件下,30s内催化分解8mL浓度为
根据图2可发现:该实验条件下,30s内催化分解8mL浓度为![]() 的双氧水,MnO2的最小用量为0.08g,因为当MnO2的质量为0.08g时双氧水在30s内仍能全部分解,到0.06g时双氧水没有完全分解。
的双氧水,MnO2的最小用量为0.08g,因为当MnO2的质量为0.08g时双氧水在30s内仍能全部分解,到0.06g时双氧水没有完全分解。
![]() Ⅱ
Ⅱ![]() 根据图2可知:a 二氧化锰用量越多,产生氧气并没有增加,只是分解速率加快,故错误;
根据图2可知:a 二氧化锰用量越多,产生氧气并没有增加,只是分解速率加快,故错误;
b 反应容器的气密性,对实验所测数据的精确度有影响,如果气密性不好,则压强的数据有偏差,故正确;
c 由图像知,不同质量的催化剂对产物的质量没有影响,因产生的氧气质量一样则氧气的体积一样,最终的压强也是相同的,所以称量的二氧化锰质量的精确度对实验装置中最终的压强大小没有影响,故正确。故选bc。
[知识拓展]
若实验中ag氧化铁中a=0.25,则其中氧元素的质量为![]() =0.075g 。若经过精密仪器测得该氧化铁样品中铁元素和氧元素的质量比为21∶8,因为氧化铁中铁元素与氧元素质量比为7∶3即21∶9,所以另一种铁的氧化物中铁氧元素的质量比应大于21∶8,氧化亚铁中铁氧元素质量比为7∶2即21∶6,四氧化三铁中铁氧元素质量比为21∶8,故选氧化亚铁。
=0.075g 。若经过精密仪器测得该氧化铁样品中铁元素和氧元素的质量比为21∶8,因为氧化铁中铁元素与氧元素质量比为7∶3即21∶9,所以另一种铁的氧化物中铁氧元素的质量比应大于21∶8,氧化亚铁中铁氧元素质量比为7∶2即21∶6,四氧化三铁中铁氧元素质量比为21∶8,故选氧化亚铁。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案