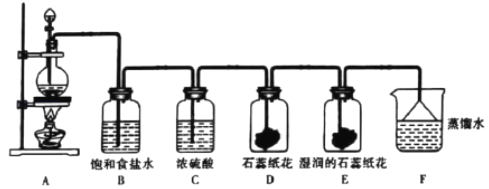
题目内容
【题目】海水中含有丰富的镁元素,目前世界上生产的镁60%来自于海水。海水晒盐后的母液称作苦卤水,其主要成分为MgCl2和NaCl(其他成分在本工艺中不做考虑)。工业上以苦卤水为原料制取金属镁的流程如下:
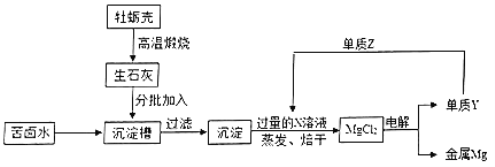
(1)沉淀槽中发生了两个化学反应,它们的基本反应类型为化合反应和_____。
(2)Y与Z反应后的产物溶于水可得X溶液,从而实现了Y的再利用,则Z的化学式为_____。
(3)蒸发、烘干后得到的MgCl2固体中可能含有的杂质是_____(填化学式)。
【答案】复分解反应 H2 CaCl2
【解析】
(1)贝壳(主要成分是碳酸钙)高温煅烧生成氧化钙,氧化钙与水反应生成氢氧化钙,属于化合反应;氯化镁与氢氧化钙反应生成氯化钙和氢氧化镁沉淀,属于复分解反应;所以沉淀槽中的两个化学反应基本类型为化合反应和复分解反应;
(2)氯化镁电解为分解反应,产物为镁和氯气,单质Y为氯气,氯气和氢气反应生成氯化氢,氯化氢溶于水形成盐酸溶液故Z是H2;
(3)氢氧化钙如果过量,过滤,沉淀上可能附有氢氧化钙,氢氧化钙与盐酸反应生成氯化钙,烘干后得到的MgCl2中可能含有的杂质是CaCl2。

【题目】如表中是四种常见的食品添加剂。根据信息回答问题
名称 | 亚硝酸钠 | 阿斯巴甜 | β﹣胡萝卜素 | 环七糊精 |
化学式 | NaNO2 | C14H18O5N2 | C40H56 | (C6H10O5)7 |
类别 | 防腐剂护色剂 | 甜味剂 | 着色剂营养强化剂 | 增稠剂 |
最大使用量(每1kg) | 腊肉0.15g | 饮料0.5g | 淡奶油0.02g | 胶基糖果20.0g |
(1)上述四种物质中不属于有机物的是___。
(2)阿斯巴甜___(填“属于”或“不属于”)糖类。
(3)添加了阿巴斯甜的某饮料中,经检测含氮元素的质量分数为0.028%(除阿巴斯甜,其它物质不含氮元素)。则该饮料中阿巴斯甜的质量分数为是否超出最大用量___(填“是”或“否”)。
(4)“我国应该禁止使用所有的食品添加剂”,这种说法是否正确并说明理由:___(写一条即可)