题目内容
【题目】某化学兴趣小组在探究“复分解反应发生的条件”时,选做了如图1所示的三个实验:(提示:BaCl2溶液呈中性,Na2CO3溶液呈碱性。)
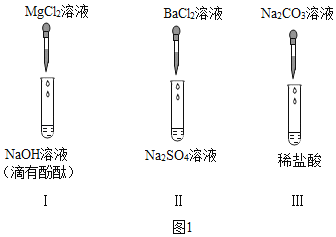
祺祺:向试管I中慢慢滴入MgCl2溶液,并不断振荡,至溶液颜色恰好变为无色为止。请写出该反应的化学方程式___。
雯雯:分别完成试管II和I中的两个实验后,接着进行如图2探究,请分析后作答:
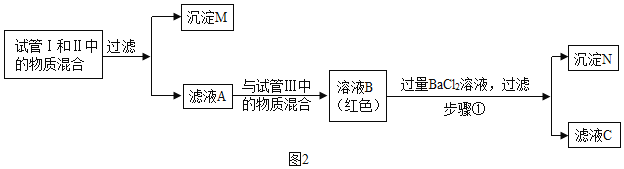
(1)雯雯经过分析推断,试管Ⅲ反应后所得溶液中一定含有的溶质是___;步骤①中一定发生的反应的化学方程式是___。
(2)祺祺把沉淀M、N混合后加入AgNO3溶液和过量的稀硝酸,观察到的实验现象是___;实验结束,祺祺把反应后的混合物与滤液C全部倒入废液缸中,则废液缸内上层清液中,除酚酞外一定含有的溶质有___。
【答案】MgCl2+2NaOH=Mg(OH)2↓+2NaCl NaCl、Na2CO3 BaCl2+Na2CO3=BaCO3↓+2NaCl 沉淀部分溶解,有气泡产生 Ba(NO3)2、Mg(NO3)2、NaNO3、HNO3
【解析】
祺祺:向试管I中慢慢滴入MgCl2溶液,并不断振荡,至溶液颜色恰好变为无色,氯化镁和氢氧化钠恰好完全反应生成氢氧化镁沉淀和氯化钠,该反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl。故填:MgCl2+2NaOH=Mg(OH)2↓+2NaCl。
雯雯:(1)雯雯经过分析推断,滤液A与试管Ⅲ中的物质混合后溶液显红色,说明溶液显碱性,即溶液中含有碳酸钠,因此反应后试管Ⅲ所得溶液中一定含有的溶质是稀盐酸和碳酸钠反应生成的氯化钠和过量的碳酸钠;步骤①中一定发生的反应是氯化钡和碳酸钠反应生成白色沉淀碳酸钡和氯化钠,反应的化学方程式是:BaCl2+Na2CO3=BaCO3↓+2NaCl。故填:NaCl、Na2CO3;BaCl2+Na2CO3=BaCO3↓+2NaCl。
(2)沉淀M、N中含有氢氧化镁、硫酸钡和碳酸钡,把沉淀M、N混合后加入AgNO3溶液和过量的稀硝酸中时,稀硝酸和氢氧化镁反应生成硝酸镁和水,和碳酸钡反应生成硝酸钡、水和二氧化碳,不能和硫酸钡反应,因此观察到的实验现象是沉淀部分溶解,有气泡产生;实验结束,把反应后的混合物与滤液C全部倒入废液缸中,则废液缸内上层清液中,除酚酞外一定含有的溶质有:碳酸钡和硝酸反应生成的硝酸钡、氢氧化镁和硝酸反应生成的硝酸镁、C中氯化钡和碳酸钠反应生成的氯化钠和硝酸银反应生成的硝酸钠、过量的硝酸,氯化钠可能和硝酸银完全反应,因此不一定含有氯化钠。故填:沉淀部分溶解,有气泡产生;Ba(NO3)2、Mg(NO3)2、NaNO3、HNO3。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案