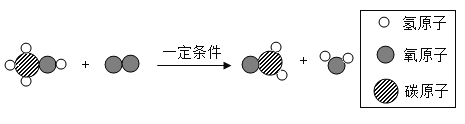
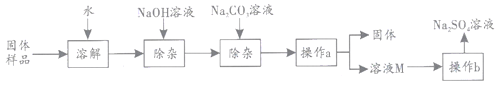
题目内容
【题目】草酸镍晶体(NiC2O4·2H2O)难溶于水,可用于制镍催化剂。
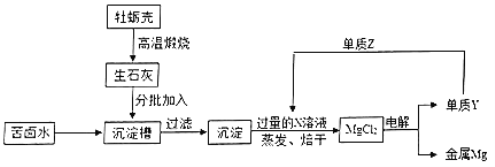
(探究一)某小组用废镍催化剂(主要成分含有Ni,还含有少量的Al2O3、Fe)制备草酸镍晶体的部分实验流程如下:
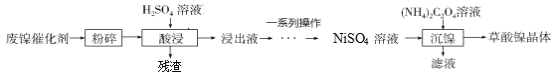
(1)“粉碎”的目的是 ______ 。
(2)“酸浸”的目的是为了得到NiSO4但会生成新的杂质,写出生成杂质的化学反应方程式: ______ (只写出一个即可)。
(3)“一系列操作”主要是为了除去溶液中铁元素对应的离子、 ______ (填写离子符号)等。
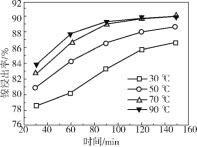
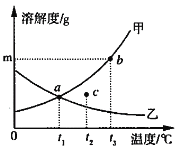
(4)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率(硫酸镍的产率)随时间变化如图。从工业生产和能源利用率的角度分析,“酸浸”的最适宜温度与时间分别为 ______ (填字母)。
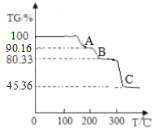
a 30℃、30min b 90℃、150min
c 70℃、120min d 90℃、120min
(5) “沉镍”后的滤液在农业中可用作 ______ 。
(6)“沉镍”过程如何证明Ni2+已沉淀完全 ______ 。
(7)将“沉镍”工序:①主要过程为:蒸发浓缩、 ______ 、过滤,所得固体用95%乙醇洗涤,得草酸镍晶体。
②用95%乙醇洗涤的目的是洗去杂质、 ______ 。
(探究二)对草酸镍晶体(NiC2O4·2H2O)晶体进行热重分析,温度与TG%的关系如图所示,
(查阅资料)①NiC2O4·2H2O加热至240℃左右完全失去结晶水;继续加热至320℃,剩余固体受热分解产生镍的氧化物、CO2和CO。
②TG% =![]()
A点物质的化学式 ______ 。
【答案】增大反应物的接触面积,加快反应速率 Fe + H2SO4= FeSO4 + H2↑ 或 Al2O3 + 3H2SO4=Al2(SO4)3 + 3H2O Al3+ c 氮肥 继续滴加草酸铵溶液,不再产生沉淀 降温结晶 便于快速干燥(填减少晶体损耗不得分) NiC2O4·H2O
【解析】
硫酸和氧化铝反应生成硫酸铝和水,铁和硫酸反应生成硫酸亚铁和氢气,乙醇易挥发且易于水混溶,草酸镍晶体加热至240℃左右完全失去结晶水,继续加热至320℃,剩余固体受热分解产生镍的氧化物、CO2和CO。
(1)“粉碎”的目的是增大反应物的接触面积,加快反应速率。
(2)“酸浸”的目的是为了得到NiSO4但会生成新的杂质,写出生成杂质的化学反应方程式![]() 或
或 ![]() 。
。
(3)“一系列操作”主要是为了除去溶液中铁元素对应的离子、 Al3+。
(4)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率(硫酸镍的产率)随时间变化如图。从工业生产和能源利用率的角度分析,“酸浸”的最适宜温度与时间分别为70℃、120min ,故选c。
(5) “沉镍”后的滤液在农业中可用作氮肥。
(6)“沉镍”过程如何证明Ni2+已沉淀完全继续滴加草酸铵溶液,不再产生沉淀。
(7)将“沉镍”工序:①主要过程为:蒸发浓缩、降温结晶、过滤,所得固体用95%乙醇洗涤,得草酸镍晶体。
②用95%乙醇洗涤的目的是洗去杂质、便于快速干燥。
[查阅资料]
草酸镍晶体加热至240℃左右完全失去结晶水,A点温度为200℃,则为草酸镍晶体,故A点物质的化学式![]() 。
。

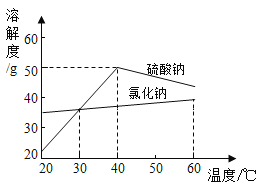
【题目】氢氧化钠是常见的碱,为探究氢氧化钠的化学性质,同学们做了如下实验:
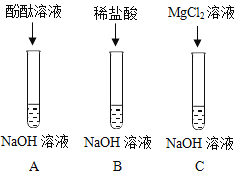
(资料)氯化镁溶液不能使酚酞溶液变红。
(1)A中溶液呈红色,说明氢氧化钠溶液显碱性,要测定它的酸碱度,可使用_____。
(2)B中没有明显的现象,该反应真的发生了吗?有同学提出,可向反应后的溶液中加入某些物质,根据相应的现象来判断,下列分析正确的有_____(填数字序号)
①加入Na2CO3溶液,如果不产生气泡,能证明反应发生
②加入CuSO4溶液,如果不产生蓝色沉淀,能证明反应发生。
③加入紫色石蕊溶液,如果溶液呈紫色,能证明反应发生。
(3)C中发生反应的化学方程式是_____。该实验证明碱能与某些盐反应。
(4)实验结束后,将三支试管中的物质倒入一只洁净的烧杯中,烧杯中出现白色沉淀,静置,上层清液无色。
(提出问题)上层清液中溶质的成分是什么呢?(指示剂除外)
(作出猜想)经过讨论,大家作出两种合理的猜想:
①NaCl;②______
(实验验证)将猜想②补充完整并设计实验加以验证。
实验操作 | 实验现象 | 结论 |
取少量上层清液于试管中,滴加____溶液 | _________ | 猜想②正确 |
老师提醒同学们,实验结束后氢氧化钠溶液仍要密封保存,原因是_____(用化学方程式表示)