题目内容
验证某混合气体含有CO和H2,并除去含有的少量CO2杂质。甲同学进行了如下实验:
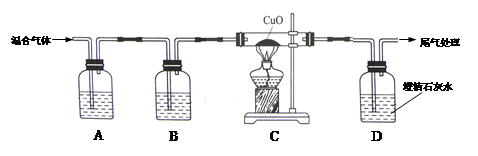
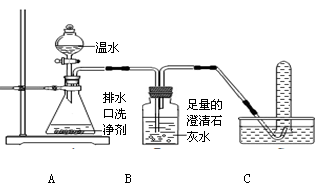
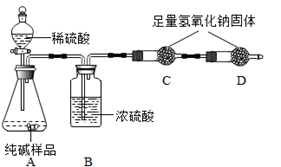
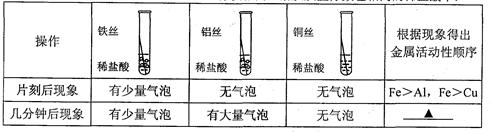
(1)A中氢氧化钠溶液的作用是 ,B中浓硫酸的作用是吸收水分,观察到C中黑色氧化铜变 ,D中澄清石灰水变浑浊,写出D中反应的化学方程式 。
(2)乙同学认为上述实验现象不能确定混合气体含有H2,他改进实验后证明了混合气体中含有H2。请写出乙同学的实验改进方法和现象 。从环境保护角度,该实验中最后导出的尾气处理方法是 。
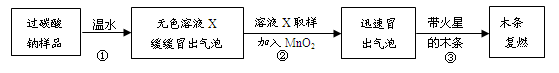
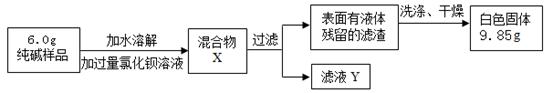
(3)丙同学对A装置反应后的溶液成分进行验证,请根据实验现象填写下列空白处:
若将Ⅱ中加入的溶液换成 (写化学式),也可得出Ⅱ中相同的结论。
写出相应的化学方程式为: 。

(1)A中氢氧化钠溶液的作用是 ,B中浓硫酸的作用是吸收水分,观察到C中黑色氧化铜变 ,D中澄清石灰水变浑浊,写出D中反应的化学方程式 。
(2)乙同学认为上述实验现象不能确定混合气体含有H2,他改进实验后证明了混合气体中含有H2。请写出乙同学的实验改进方法和现象 。从环境保护角度,该实验中最后导出的尾气处理方法是 。
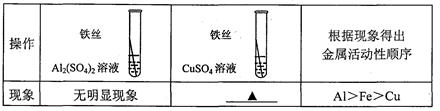
(3)丙同学对A装置反应后的溶液成分进行验证,请根据实验现象填写下列空白处:
| 实验操作过程 | 实验现象 | 实验结论 |
| Ⅰ.取待测液少量于试管中,向其中滴加适量 溶液 | 产生白色沉淀 | 溶液中含Na2CO3 |
| Ⅱ.将上述反应后的混合物静置后,再向上层清液中加入 溶液。 | 溶液呈红色 | 溶液中含NaOH |
若将Ⅱ中加入的溶液换成 (写化学式),也可得出Ⅱ中相同的结论。
写出相应的化学方程式为: 。
(1)除去二氧化碳 变红 CO2 +Ca(OH)2→Ca CO3 ↓+ H2 O
(2)在C和D之间加无水硫酸铜干燥装置,白色变蓝色(合理给分) 点燃或收集(合理即可)
(3)加可溶性钙盐(或钡盐), 酚酞 可溶性铜盐或铁盐(合理给分) NaOH+CuSO4→Cu(OH)2↓+Na2SO4
(2)在C和D之间加无水硫酸铜干燥装置,白色变蓝色(合理给分) 点燃或收集(合理即可)
(3)加可溶性钙盐(或钡盐), 酚酞 可溶性铜盐或铁盐(合理给分) NaOH+CuSO4→Cu(OH)2↓+Na2SO4
试题分析:①二氧化碳能与氢氧化钠反应,故A中氢氧化钠溶液的作用是除去二氧化碳;一氧化碳的检验是利用一氧化碳的还原性,一氧化碳还原氧化铜市场铜和二氧化碳;
②氢气还原氧化铜生成的是铜和水,那么只有检验是否有水存在即可知氢气的存在,水可以用无水硫酸铜检验;
③碳酸钠会与可溶性钙盐(或钡盐)反应生成白城沉淀,如与氯化钙反应生成碳酸钙白色沉淀;NaOH溶液呈碱性,能使无色酚酞变红;氢氧化钠能与氯化铜反应生成蓝色沉淀。

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目