题目内容
某化学兴趣小组的同学对一瓶久置的熟石灰粉末的组成进行实验探究,请你一起参与他们的探究活动。
[提出问题]这瓶熟石灰粉末是否已经变质生成了CaCO3?
[进行猜想]猜想一: 。
猜想二:熟石灰部分变成了CaCO3。
猜想三:熟石灰没有变质。
[设计实验]该小组同学对猜想一设计了下列探究方案,请你帮助他们完成下表中相关实验内容。
[反思与应用]①要证明猜想二成立,可参照上述实验方案进行探究,在步骤②中产生的实验现象是 。
②熟石灰变质的化学反应方程式为 ,因此实验室中应 保存。
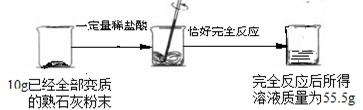
[数据处理]将10g已经全部变质的熟石灰粉末(即CaCO3)放入烧杯中,加入一定量的稀盐酸,恰好完全反应,产生气体,完全反应后所得溶液质量为55.6g。
计算:①生成气体的质量为 g ;参与反应的HCl的质量为 g;
②反应前稀盐酸中溶质的质量分数。(写出计算过程,结果精确到0.1%)
[提出问题]这瓶熟石灰粉末是否已经变质生成了CaCO3?
[进行猜想]猜想一: 。
猜想二:熟石灰部分变成了CaCO3。
猜想三:熟石灰没有变质。
[设计实验]该小组同学对猜想一设计了下列探究方案,请你帮助他们完成下表中相关实验内容。
| 实验步骤 | 实验现象 | 实验结论 |
| ①取样,加适量水,搅拌,过滤 ②取少量滤液于试管中,滴入酚酞试液 ③取少量滤渣于试管中,加入盐酸 | ②无明显变化。 ③ 。 | 猜想一成立 |
[反思与应用]①要证明猜想二成立,可参照上述实验方案进行探究,在步骤②中产生的实验现象是 。
②熟石灰变质的化学反应方程式为 ,因此实验室中应 保存。
[数据处理]将10g已经全部变质的熟石灰粉末(即CaCO3)放入烧杯中,加入一定量的稀盐酸,恰好完全反应,产生气体,完全反应后所得溶液质量为55.6g。

计算:①生成气体的质量为 g ;参与反应的HCl的质量为 g;
②反应前稀盐酸中溶质的质量分数。(写出计算过程,结果精确到0.1%)
[进行猜想]猜想一:熟石灰粉末全部变质生成了CaCO3。
[反思与应用]①滤液变红。 ②Ca(OH)2+CO2=CaCO3↓+H2O,密封。
[数据处理]计算:①4.4g ;7.3g; ②14.6% 。
| 实验步骤 | 实验现象 | 实验结论 |
| ③取少量滤渣于试管中,加入盐酸 | ③产生大量气泡,滤渣全部溶解。 | 猜想一成立 |
[反思与应用]①滤液变红。 ②Ca(OH)2+CO2=CaCO3↓+H2O,密封。
[数据处理]计算:①4.4g ;7.3g; ②14.6% 。
试题分析:依据质量守恒定律及猜想二、三故[进行猜想]猜想一:熟石灰粉末全部变质生成了CaCO3; [设计实验]③取少量滤渣于试管中,加入盐酸产生大量气泡,滤渣全部溶解。[反思与应用]①要证明猜想二成立,可参照上述实验方案进行探究,因为是部分变质,故含有氢氧化钙,在步骤②中产生的实验现象是滤液变红;②熟石灰变质的化学反应方程式为Ca(OH)2+CO2=CaCO3↓+H2O,因此实验室中应密封保存。
[数据处理]
解:①由题中叙述可知碳酸钙的质量为10g,
设能生成二氧化碳为X,需要氯化氢为Y
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 73 44
10g Y X
100:44=10g:X 100:73=10g:Y
X=4.4g y=7.3g
②有反应后的溶液可知加入的盐酸溶液的质量为55.6g+4.4g-10g=50g
溶质的质量分数为:7.3g/50g×100%=14.6%
答:能生成二氧化碳为4.4g,需要氯化氢为7.3g,盐酸的溶质的质量分数为14.6%

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目