题目内容
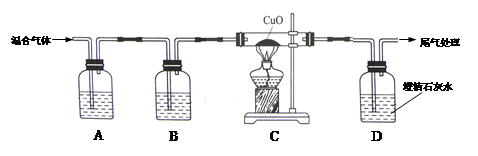
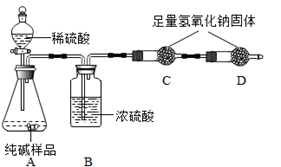
某品牌纯碱中含有少量氯化钠。某化学探究小组欲测定该品牌纯碱的纯度(即碳酸钠的质量分数)。(一)甲组同学设计如图所示实验:
【实验步骤】
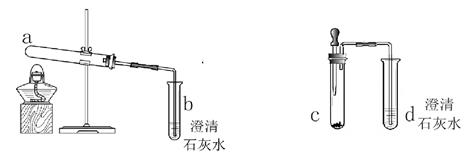
①组装好如图仪器,并检查 ;
②称取13.0g样品放入锥形瓶中,加入少量蒸馏水溶解,并在其他装置中加入相应的药品;
③称量装置C的质量;
④打开分液漏斗旋塞滴入稀硫酸,直到不再产生气泡为止;
⑤再次称量装置C 的总质量;
⑥计算出样品中碳酸钠的质量分数。
【实验分析】
(1)A装置中反应的化学方程式为 。
(2)B装置的作用是 。
(3)如果没有B装置则所测样品中碳酸钠的质量分数 。(填偏大、偏小、不变)
(4)小明提出能否用盐酸代替硫酸?同学们经过讨论认为不能,理由是 。
(5)称得纯碱样品的质量为13.0g,实验前、后C装置(包含药品)的质量分别为61.2g和65.6g,则该纯碱样品的纯度为 %(精确到0.1%)。
(二)乙组同学采用生成沉淀的方法来测定样品中纯碱的质量分数,设计了如下实验:
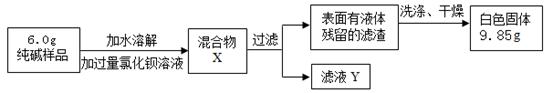
(1)判断加入氯化钡溶液是否过量的合适方法是 ,然后观察现象判断。
A.静置混合物X,向上层清液中继续滴加氯化钡溶液,若无白色沉淀生成,则氯化钡已经过量;
B.向混合物X中滴加稀硫酸,若有白色沉淀生成则说明氯化钡已经过量。
(2)判断滤渣是否洗涤干净,可以采取向最后的洗出液中滴加 ,然后观
察现象判断。
A.氯化钡溶液 B.稀硫酸 C.硝酸银溶液 D.稀盐酸
(3)根据实验数据,乙组测得样品中碳酸钠的质量分数为 %(精确到0.1%)。
【实验反思】
甲乙两组同学所测该品牌中碳酸钠的质量分数,你认为 组(填“甲”或“乙”)更准确,另一组存在较大偏差的原因可能是 。

【实验步骤】
①组装好如图仪器,并检查 ;
②称取13.0g样品放入锥形瓶中,加入少量蒸馏水溶解,并在其他装置中加入相应的药品;
③称量装置C的质量;
④打开分液漏斗旋塞滴入稀硫酸,直到不再产生气泡为止;
⑤再次称量装置C 的总质量;
⑥计算出样品中碳酸钠的质量分数。
【实验分析】
(1)A装置中反应的化学方程式为 。
(2)B装置的作用是 。
(3)如果没有B装置则所测样品中碳酸钠的质量分数 。(填偏大、偏小、不变)
(4)小明提出能否用盐酸代替硫酸?同学们经过讨论认为不能,理由是 。
(5)称得纯碱样品的质量为13.0g,实验前、后C装置(包含药品)的质量分别为61.2g和65.6g,则该纯碱样品的纯度为 %(精确到0.1%)。
(二)乙组同学采用生成沉淀的方法来测定样品中纯碱的质量分数,设计了如下实验:

(1)判断加入氯化钡溶液是否过量的合适方法是 ,然后观察现象判断。
A.静置混合物X,向上层清液中继续滴加氯化钡溶液,若无白色沉淀生成,则氯化钡已经过量;
B.向混合物X中滴加稀硫酸,若有白色沉淀生成则说明氯化钡已经过量。
(2)判断滤渣是否洗涤干净,可以采取向最后的洗出液中滴加 ,然后观
察现象判断。
A.氯化钡溶液 B.稀硫酸 C.硝酸银溶液 D.稀盐酸
(3)根据实验数据,乙组测得样品中碳酸钠的质量分数为 %(精确到0.1%)。
【实验反思】
甲乙两组同学所测该品牌中碳酸钠的质量分数,你认为 组(填“甲”或“乙”)更准确,另一组存在较大偏差的原因可能是 。
【实验步骤】①装置的气密性
【实验分析】(1)Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ (2)除去水蒸气 (3)偏大
(4)盐酸挥发出氯化氢气体被装置C吸收,影响实验测定 (5)81.5% (二)(1)A (2)B、C
【实验反思】乙组 因甲组中生成的二氧化碳残留在锥形瓶中,未被装置C吸收,影响实验测定。
【实验分析】(1)Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ (2)除去水蒸气 (3)偏大
(4)盐酸挥发出氯化氢气体被装置C吸收,影响实验测定 (5)81.5% (二)(1)A (2)B、C
【实验反思】乙组 因甲组中生成的二氧化碳残留在锥形瓶中,未被装置C吸收,影响实验测定。
试题分析:依据实验目的:要测定该品牌纯碱的纯度(即碳酸钠的质量分数),通过测定二氧化碳的质量俩确定碳酸钠的质量,所以要保证二氧化碳的质量准确。
(一)首先要检查装置的气密性,确保装置不漏气;
【实验分析】(1)A装置中是硫酸与碳酸钠生成氯化钠、二氧化碳和水的反应,化学方程式为Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;(2)因为生成的气体中含有水蒸气,所以B装置是除去二氧化碳中的水蒸气,得到纯净的二氧化碳;(3)C中氢氧化钠固体能吸水并且能与二氧化碳反应,所以如果没有B装置,会使C的质量增大,即生成二氧化碳的质量增大,从而利用化学方程式计算出的碳酸钠质量增大,使所测样品中碳酸钠的质量分数偏大;(4)盐酸具有挥发性,盐酸挥发出氯化氢气体被装置C吸收,影响实验测定,所以不能替代稀硫酸;(5)因为C增大的质量是生成的二氧化碳的质量,为65.6g-61.2g=4.4g,再依据碳酸钠和稀硫酸反应的化学方程式计算出碳酸钠的质量为10.6g,
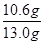 ×100%≈81.5%;
×100%≈81.5%;(二)①判断加入氯化钡溶液是否过量的合适方法是:静置混合物X,向上层清液中再滴少许氯化钡溶液,如有沉淀生成,说明氯化钡溶液不足;不能用稀硫酸,因为如果氯化钡不过量,则有碳酸钠剩余,而稀硫酸能与碳酸钠反应生成气体,使实验结果不准确,故选A;
②判断滤渣是否洗涤干净,实际上是检验过量的氯化钡溶液是否洗净;氯化钡可与稀硫酸和碳酸钠溶液反应生成硫酸钡和碳酸钡沉淀,通过观察是否有沉淀生成可判断氯化钡溶液是否洗净;故选BC;
③根据白色固体是碳酸钡为9.85g,据其质量结合方程式BaCl2+Na2CO3═BaCO3↓+2NaCl计算出碳酸钠的质量5.3g,进而计算样品中碳酸钠的质量分数:
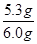 ×100%≈88.3%;
×100%≈88.3%;【实验反思】乙组测定结果更准确, 因甲组实验装置中反应前充满空气,反应后是生成的二氧化碳,残留在锥形瓶中,未被装置C吸收,影响实验测定,使实验结果偏少。

练习册系列答案
相关题目



 Na2CO3 + H2O + CO2↑,根据以上实验结论和所学知识,小明对探究问题又提出了第4个猜想,并在以上实验的基础上,利用装置2完成实验验证,其实验方案为____。
Na2CO3 + H2O + CO2↑,根据以上实验结论和所学知识,小明对探究问题又提出了第4个猜想,并在以上实验的基础上,利用装置2完成实验验证,其实验方案为____。