题目内容
【题目】化学是一门以实验为基础的自然科学。
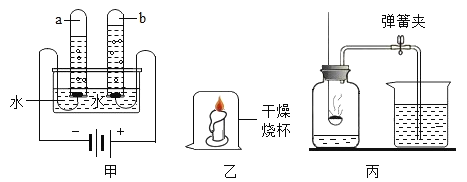
(1)用甲装置测定水的组成。负极与正极产生气体的质量比为_____。甲装置中发生反应的化学方程式为_____。
(2)小红同学用乙装置进行探究实验,观察现象得出结论:“蜡烛中含有氢元素”,该判断所依据的现象是_____。
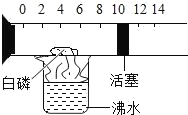
(3)用丙装置测定空气中氧气的含量。下列有关该实验的说法中,错误的是_____(填字母)。
A 实验时红磷一定要足量 B 点燃红磷前先用弹簧夹夹紧乳胶管
C 红磷熄灭后立刻打开弹簧夹 D 最终进入瓶中水的体积约为消耗氧气的体积
(4)为测定金属氧化物着色剂中的金属含量,现将![]() 、
、![]() 、
、![]() 的混合物16克,与109.5克20%的稀盐酸混合后恰好完全反应,则此金属氧化物着色剂中金属元素的含量是_____。
的混合物16克,与109.5克20%的稀盐酸混合后恰好完全反应,则此金属氧化物着色剂中金属元素的含量是_____。
【答案】1:8 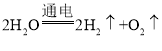 烧杯内壁上有水雾 C 70%
烧杯内壁上有水雾 C 70%
【解析】
(1)用甲装置测定水的组成。正极产生的气体是氧气,负极产生的气体是氢气。负极与正极产生气体的质量比为(1×2×2):(16×2)=1:8;水在通电的条件下分解,生成氢气和氧气,故甲装置中发生反应的化学方程式为: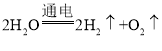 ;
;
(2)烧杯内壁上有水雾,证明蜡烛中含有氢元素;
(3)A、红磷要足量,将氧气完全消耗掉,选项正确;
B、为防止测量过程中水进入反应容器,一般点燃红磷前先用弹簧夹夹紧乳胶管,选项正确;
C、红磷熄灭后容器中温度较高,气体膨胀,为使结果更准确,一般是冷却到室温后再打开弹簧夹,选项错误;
D、红磷燃烧消耗氧气,冷却到室温后,装置内压强降低,在大气压的作用下,最终进入瓶中水的体积约为消耗氧气的体积,选项正确。故选C;
(4)氧化铁、氧化铜和氧化铝与稀硫酸反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O,CuO+2HCl═CuCl2+H2O:Al2O3+6HCl═2AlCl3+3H2O由于氧化铝、氧化铜和氧化铁的混合物与109.5克20%的稀盐酸混合后恰好完全反应,分析化学方程式可以知道氧化铝、氧化铜和氧化铁中的氧元素转变为水中的氧元素,即混合物中氧元素的质量和水中氧元素的质量相等,由方程式可得盐酸与水的关系式为2HCl~H2O,设生成水中氧元素的质量为x,109.5克20%的稀盐酸中氯化氢的质量=109.5g×20%=21.9g,则:
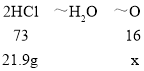
![]()
x=4.8g
则此金属氧化物着色剂中金属元素的含量=![]() ×100%=70%。
×100%=70%。