题目内容
【题目】实验室有一瓶白色固体,可能由Ba(NO3)2、NaCl、Na2CO3、Na2SO4中的两种或两种以上组成,某兴趣小组为确定其成分,进行了如下实验研究,请你参与完成相关问题
Ⅰ(初步探究)兴趣小组的实验设计及现象如下:
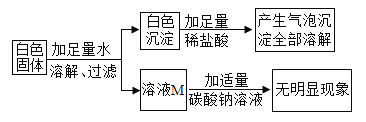
(初步结论)(1)原白色固体中一定有_______(填化学式,下同),一定没有_______。
(2)溶液M中的溶质一定有NaNO3,一定没有_______。
(交流讨论)为确定原固体的成分,需对溶液M中的溶质进行进一步确认
Ⅱ继续研究
(提出问题)溶液M中溶质的成分是什么
(提出猜想)
猜想一:NaNO3 猜想二:NaNO3、Na2CO3
猜想三:NaNO3、NaCl 猜想四:NaNO3、Na2CO3、NaCl
实验与结论
实验 | 步骤 | 现象 | 结论 |
一 | 取适量溶液M于试管中,滴加少量稀硝酸 | 有气泡产生 | 猜想一、三不成立 |
二 | 取实验一所得溶液于试管中,滴加适量硝酸银溶液 | 产生白色沉淀 | 猜想四成立 |
(反思与评价)
兴趣小组内有同学认为得出“猜想四成立”的实验设计不合理,原因是_______,改进措施是_______
(实验结论)同学们经过交流,讨论、实验,圆满完成了这次探究活动。
【答案】Na2CO3、Ba(NO3)2 Na2SO4 Ba(NO3)2 不能确定NaCl(或Cl-)一定存在(或不足以证明NaCl(或Cl-)一定存在)(或实验一时滴加的少量稀硝酸未将Na2CO3除尽,对NaCl的鉴别造成影响) 将实验一中的少量稀硝酸改为足量稀硝酸(或向实验二产生的白色沉淀中加入足量稀硝酸,白色沉淀部分溶解)
【解析】
初步结论:
(1)硝酸钡与碳酸钠反应生成碳酸钡和硝酸钠,硫酸钠与硝酸钡反应生成硫酸钡和硝酸钠,碳酸钡能与稀硝酸反应,能溶于稀硝酸,硫酸钡不溶于稀硝酸。根据题目给出的流程图和信息:白色固体中加足量水溶解、过滤,得到白色沉淀和无色溶液M;白色固体中加足量的稀硝酸,产生气泡,沉淀全部溶解,说明沉淀全部是碳酸钡,即原白色固体中一定有Na2CO3、Ba(NO3)2,一定没有Na2SO4,氯化钠可能有,也可能没有;
(2)硝酸钡与碳酸钠反应生成碳酸钡沉淀和硝酸钠,溶液M中加入碳酸钠溶液,无明显现象,说明溶液M中的溶质一定有NaNO3,一定没有Ba(NO3)2;
反思与评价:
碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,碳酸钠与硝酸银反应生成碳酸银沉淀和硝酸钠,氯化钠与硝酸银反应生成氯化银和硝酸钠,氯化银不溶于稀硝酸,碳酸银能与稀硝酸反应生成硝酸银、水和二氧化碳,碳酸银能溶于稀硝酸。兴趣小组内有同学认为得出“猜想四成立”的实验设计不合理,原因是不能确定NaCl(或Cl-)一定存在(或不足以证明NaCl(或Cl-)一定存在)(或实验一时滴加的少量稀硝酸未将Na2CO3除尽,对NaCl的鉴别造成影响);改进措施是将实验一中的少量稀硝酸改为足量稀硝酸(或向实验二产生的白色沉淀中加入足量稀硝酸,白色沉淀部分溶解)。