题目内容
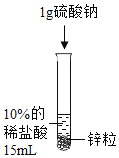
【题目】(4分)请根据下图所示的实验过程和提供的数据计算:
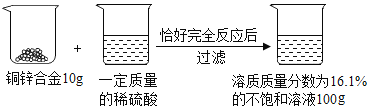
(1)生成氢气的质量。
(2)合金中铜的质量分数。
(3)所加稀硫酸的质量。
【答案】(1)0.2g(2)35% (3)93.7 g
【解析】
试题分析:根据硫酸锌质量,利用化学方程式进行计算,得出氢气和锌的质量;再利用质量守恒定律进行计算得出稀硫酸质量。
解:生成ZnSO4的质量为100g×16.1%=16.1g
设:生成氢气的质量为x,消耗锌的质量为y。
Zn+H2SO4=ZnSO4+H2↑
65 161 2
y 16.1g x
2 :x=161:16.1g
x= 0.2g
65 :y =161:16.1g
y= 6.5 g
(10 g -6.5 g)/10 g ×100%=35%
所加稀硫酸的质量:100 g+0.2 g-6.5 g=93.7 g
答:略。

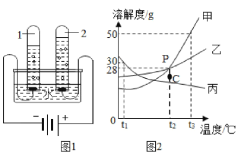
【题目】某化学兴趣小组对氢气的实验室制法,进行了一系列实验探究。
(1)小组用锌与稀盐酸反应制取氢气,该反应的化学方程式为_____。
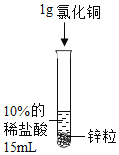
(2)为了加快锌与稀盐酸的反应速率,老师提示可向反应物中加入少量硫酸铜固体,为了弄明白速率加快的原因,小组同学提出了以下猜想。
(猜想与假设)甲同学:可能与硫酸根离子有关;
乙同学:可能与铜离子有关;
丙同学:可能与铜单质有关。丙同学猜想的依据是_____。
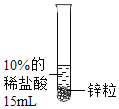
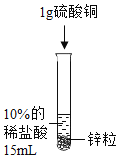
设计并进行实验室温时,小组同学按下表进行实验,观察并记录现象。
实验序号 | ① | ② | ③ | ④ |
实验 |
|
|
|
|
产生气泡的快慢 | 较快 | 明显加快 | 较快 | 明显加快 |
(分析并得出结论)
(3)由实验①和实验③发现反应速率几乎没有变化得出甲同学的猜想_____(选填“正确”或“不正确”)。
(4)实验④是将硫酸铜换成氯化铜进一步验证猜想,丙同学认为不需要替换试剂,只需通过观察实验②的现象就可以验证,该反应的现象为_____。此反应发生后反应速率加快依然较明显,小组同学得出_____的猜想正确。
(5)请你重新设计一个实验方案验证丙同学的猜想。实验方案:_____。
【题目】某兴趣小組为测定石灰石中碳酸钙的质量分数,取12g石灰石样品加入烧杯中,将120g稀盐酸平均分四次加入,充分反应后(杂质不溶于水也不与稀盐酸反应),测得实验数据如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
加入稀盐酸的质量/g | 30 | 30 | 30 | 30 |
剩余固体的质量/g | 9 | 6 | 3 | 2 |
分析数据计算(結果精确到0.1%):
(1)该祥品中碳酸钙的质量分数为__________。
(2)所用稀盐酸的溶质质量分数为__________。
(3)12g样品中的碳酸钙恰好完全反应时所得溶液的溶质质量分数为__________。
【题目】一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是( )
物质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量/g | 50 | 2 | 0 | 0 |
反应后的质量/g | 23 | X | 24 | 3 |
A. x的值等于2B. 甲一定是化合物
C. 该反应是化合反应D. 反应时丙和丁的质量比为8:1